В мире химии одним из ключевых понятий является атомная масса. Это значение имеет большое значение при изучении элементов, соединений и реакций. Понимание атомной массы помогает химикам проводить различные расчеты, определять состав элементов и предсказывать итоги химических процессов.
Атомная масса представляет собой массу одного атома химического элемента, выраженную в атомных массовых единицах (аму). Эта единица измерения была предложена на основе стандартизованной массы атома углерода-12. Таким образом, атом углерода-12 имеет атомную массу в точности равную 12 аму.
Однако, не все атомы элементов имеют такую же атомную массу. Это связано с тем, что атомы могут иметь различное количество нейтронов в своем ядре. В результате, у разных изотопов (атомов одного элемента с разным числом нейтронов) атомная масса может быть различной. Для большинства элементов чаще всего встречается несколько изотопов.
Значение атомной массы в химии
Атомная масса играет важную роль в химии, так как она позволяет установить связь между микроскопическим и макроскопическим уровнями вещества. Атомная масса определяет, какие атомы составляют данное вещество и в каком количестве.
Атомная масса измеряется в атомных единицах массы (a.u.), которые принято считать примерно равными массе протона или нейтрона. Одна атомная единица массы составляет около 1,66 * 10^-27 килограмма.
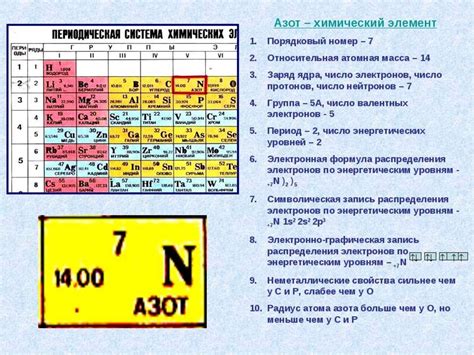
Атомная масса элемента равна средней массе атомов данного элемента, учитывая их изотопы и их относительную частоту в природе. Она может быть выражена в атомных единицах массы или в граммах на моль. Например, атомная масса кислорода равна приблизительно 16,00 а.е.м. или 16,00 г/моль.
Знание атомной массы позволяет рассчитывать мольную массу вещества, которая указывает на количество граммов вещества в одном моле. Мольная масса вычисляется путем сложения атомных масс всех атомов в молекуле. Например, мольная масса воды (H₂O) равна приблизительно 18,02 г/моль - 2 грамма за каждый атом водорода и 16 граммов за атом кислорода.
Значение атомной массы также позволяет проводить расчеты вещественных реакций и определять количество вещества, которое участвует или получается в результате реакции. Поэтому понимание атомной массы - важный аспект для химиков и научных исследований в области химии.
Определение и основные понятия

В химии существуют два различных типа атомных масс: атомная масса и относительная атомная масса. Атомная масса представляет собой массу одного атома, в то время как относительная атомная масса указывает на отношение массы атома к массе 1/12 атома углерода-12.
Атомные массы могут быть найдены на периодической таблице элементов. Они представлены в виде чисел рядом с символами химических элементов. Например, атомная масса углерода равна приблизительно 12 у.
Атомную массу можно использовать для решения различных химических задач. Например, вычислить массу вещества, зная количество атомов или молекул вещества. Также она может быть использована для вычисления процентного содержания элементов в химических соединениях.
В основе атомных масс лежит понятие атомного числа - это количество протонов в атоме элемента, которое также определяет его химические свойства. Количество нейтронов в атоме также влияет на атомную массу, так как нейтроны добавляют массу атому без изменения его химических свойств.
Значение атомной массы для расчетов

Для химических расчетов важно знать точную атомную массу каждого элемента, поскольку она позволяет определить мольную массу вещества. Мольная масса выражается в граммах и равна числу граммов, соответствующему 1 молю вещества. Она удобно используется для перевода количества вещества из массовых единиц в мольные и наоборот.
Точная атомная масса каждого элемента прописана в таблице Менделеева и указывается в атомных массовых единицах (аму). Она рассчитывается как средневзвешенная масса изотопов данного элемента, принимая во внимание их относительные содержания в природе.
Кроме расчетов мольной массы, значение атомной массы также позволяет проводить расчеты стехиометрических соотношений в реакциях, расчеты количества вещества, объема газов и других важных параметров.
Методы измерения атомной массы

1. Метод использования масс-спектрометрии
Масс-спектрометрия - это метод, основанный на анализе отдельных атомов или молекул с помощью их массы и заряда. Сначала образец разбивается на ионы, которые затем ускоряются и разделяются в магнитном поле в зависимости от их отношения массы к заряду. Затем измеряется количество ионов разных масс, что позволяет определить атомную массу элемента с высокой точностью.
2. Метод использования изотопов
Изотопы - это атомы одного элемента, но с различными числами нейтронов в ядре. Изотопы могут иметь разные атомные массы. Путем измерения отношения концентрации изотопов в образце, можно определить среднюю атомную массу элемента. Этот метод особенно полезен при расчетах смесей элементов.
3. Метод использования хроматографии
Хроматография - это метод разделения и анализа химических смесей. Специальные инструменты, называемые хроматографы, используются для разделения различных компонентов смеси на основе их физико-химических свойств. Путем измерения времени задержки или скорости перемещения частицы, можно определить ее массу и получить информацию о массе атома.
Учет атомной массы является основой для решения множества химических задач и позволяет проводить точные расчеты реакций и процессов. Знание методов измерения атомной массы позволяет ученым получать более точные данные и расширять наши знания в области химии.
Применение атомной массы в химических процессах
Атомная масса играет важную роль во многих химических процессах и реакциях. Она определяет количество атомов или молекул вещества в данной массе. Знание атомной массы позволяет ученым проводить точные расчеты и прогнозировать результаты химических реакций.
Одним из основных применений атомной массы является расчет стехиометрических коэффициентов в реакциях. Стехиометрия - это наука, изучающая количественные соотношения между реагентами и продуктами в химических реакциях. Атомная масса позволяет определить молекулярные и ионные формулы веществ, а также вычислить массу продуктов, образующихся при проведении реакции.
Другим важным аспектом применения атомной массы является вычисление молярной массы веществ. Молярная масса - это масса одного моля вещества, выраженная в граммах. Зная молярную массу вещества, можно рассчитать количество вещества по его массе и наоборот. Это особенно полезно при проведении лабораторных экспериментов, анализе образцов и синтезе новых веществ.
Атомная масса также применяется при решении задач по различным видам химических расчетов. Например, в химической аналитике атомная масса используется для определения содержания вещества в образцах по гравиметрическим и волюметрическим методам. Также атомная масса помогает в определении плотности вещества и его состава.
В области физической химии атомная масса применяется для расчета концентрации растворов и реакционных смесей. Кроме того, она участвует в законах сохранения массы и энергии, помогая определить массовые и энергетические балансы в химических реакциях.



