Ферум (железо) является одним из самых распространенных и важных элементов в химии и технологии. Его основная природная форма - гематит (Fe2O3), который широко применяется в различных областях, включая металлургию, катализ, электротехнику и магнетизм. Реакции с участием гематита имеют особое значение, поскольку они являются ключевыми для преобразования Fe2O3 в полезные продукты, такие как железо и сталь.
Одной из наиболее известных реакций с участием гематита является процесс получения металлического железа из железной руды. В этой реакции гематит взаимодействует с углеродом при высокой температуре, что приводит к образованию чистого железа и углекислого газа. Этот процесс, известный как восстановление железа, является одним из основных способов получения металла, который затем широко используется в производстве различных изделий и структур.
Гематит также проявляет интересные свойства в реакциях окисления и взаимодействия с кислородом. При нагревании Fe2O3 со взрывоопасными веществами, такими как алюминий, происходит сильное окисление с образованием кислорода и высокой температуры, что может быть использовано в пиротехнических смесях и ракетных топливах.
Наконец, гематит является полупроводником с полуизолирующими свойствами, что делает его полезным в электротехнике. Он может быть использован в качестве материала для создания полупроводниковых приборов, таких как диоды и транзисторы. Также, его магнитные свойства позволяют использовать гематит в производстве магнитных записывающих носителей, таких как жесткие диски и магнитные ленты.
Ферум в химических соединениях

Ферум (Fe2O3) хорошо растворяется в кислотах, особенно в соляной кислоте (HCl). В результате реакции ферума с кислотами образуется соль железа(III) и выделяется молекулярный водород. Это свойство делает ферум очень полезным в процессе производства соляной кислоты и других химических соединений.
Ферум (Fe2O3) также может взаимодействовать с щелочами, образуя соли железа(III). Эта реакция широко используется в процессе получения различных железосодержащих соединений, таких как ферум(III) оксалат и ферум(III) гидроксид.
Одним из самых известных свойств ферума является его способность округляться в магнетит (Fe3O4) при нагревании в атмосфере, богатой кислородом. Магнетит является одним из наиболее популярных магнитных материалов и широко используется в различных сферах, включая электронику и компьютерную индустрию.
Ферум (Fe2O3) также играет важную роль в фотохимических процессах. Он может использоваться в качестве катализатора в преобразовании солнечной энергии в химическую энергию, например, при разложении воды на кислород и водород.
Интересно отметить, что ферум (Fe2O3) является одним из самых стабильных соединений железа и обладает высокой термической стабильностью. Это делает его незаменимым материалом для производства огнеупорных и термостойких материалов.
Реакция Ферума с кислородом

Взаимодействие ферума с кислородом может происходить в различных условиях, например, в присутствии влаги или воздуха. При этом результирующий продукт реакции является оксидом ферума (Fe2O3), также известным как ржавчина.
Реакция ферума с кислородом является окислительно-восстановительной реакцией, при которой железо теряет электроны и окисляется, а кислород получает электроны и восстанавливается. Эта реакция обычно сопровождается выделением тепла и света.
Ферум реагирует с кислородом:
4 Fe2O3 + 3 O2 → 2 Fe2O3
Реакция ферума с кислородом широко используется в промышленности, например, при производстве стали. Окисный слой на поверхности металла защищает его от коррозии и сохраняет его прочность и прочие свойства.
Химическое взаимодействие Ферума с водой
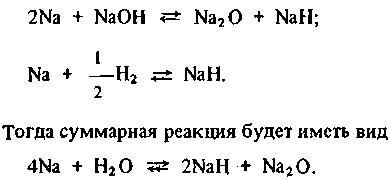
Ферум, представленный оксидом железа (Fe2O3), проявляет химическую активность в присутствии воды. При контакте с водой Ферум образует гидроксид железа (Fe(OH)3), который может претерпевать дальнейшие превращения.
Реакция Ферума с водой можно представить следующим уравнением:
Fe2O3 + 3H2O → 2Fe(OH)3
В данной реакции каждую молекулу Fe2O3 окисляет три молекулы воды, образуя две молекулы гидроксида железа.
Гидроксид железа, образовавшийся в результате реакции Ферума с водой, имеет коллоидное состояние и проявляет собственные свойства. Он может служить инициатором для дальнейших химических превращений, например, окисления или осаждения веществ.
Химическое взаимодействие Ферума с водой является одним из способов использования оксида железа в различных технических и промышленных процессах, а также в жизни человека.
Ферум и реакция с кислотами

Взаимодействие ферума с кислотами может протекать в нескольких направлениях. Одним из наиболее известных примеров является реакция ферума с соляной кислотой (HCl). При данной реакции образуется хлорид железа (FeCl3) и высвобождается водород (H2):
- Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O
Эта реакция является одной из самых распространенных для ферума и соляной кислоты. Она позволяет получать хлорид железа, который широко используется в различных отраслях промышленности.
Кроме того, ферум может реагировать с другими кислотами, например, с азотной кислотой (HNO3). При данной реакции образуется нитрат железа (Fe(NO3)3) и высвобождается оксид азота (NO2):
- 2 Fe2O3 + 6 HNO3 → 2 Fe(NO3)3 + 3 H2O + 2 NO2
Эта реакция также имеет практическое значение и используется для получения нитрата железа, который применяется в производстве удобрений, красителей и других химических продуктов.
Ферум и его окисление
Окисление ферума - это процесс, при котором атомы ферума теряют электроны. В случае трехокиси железа, два атома ферума занимают окислительное состояние +3 (Fe^3+), теряя три электрона и образуя положительно заряженные ионы. Другими словами, в трехокиси железа ферум находится в своем наиболее окисленном состоянии.
Такое окисление ферума имеет большое значение во многих химических реакциях. Например, в процессе восстановления трехокиси железа в металлический ферум, окислитель восстанавливается до менее окисленного состояния, образуя молекулярный кислород (O2) и выпуская энергию. Окисление железа также происходит в процессе коррозии, когда ферум реагирует с кислородом и влагой воздуха, образуя ржавчину (гидроокись железа) и при этом разрушая металл.
Таким образом, понимание свойств и поведения ферума при окислении имеет важное значение в различных областях науки и технологии, таких как металлургия, электрохимия, коррозионная защита и многих других.
Ферум и его влияние на окружающую среду

Одно из важнейших свойств Ферума в химических реакциях – его способность окисляться и восстанавливаться. Данное свойство играет важную роль в окружающей среде. Когда Ферум окисляется, он образует ржавчину – красновато-коричневое соединение, которое часто встречается на металлических поверхностях из железа или его сплавов.
Формирование ржавчины имеет как позитивные, так и негативные последствия для окружающей среды. Одно из позитивных последствий – влияние на устойчивость структур и материалов. Ржавчина может служить неким защитным слоем, который предотвращает дальнейшую коррозию и разрушение.
Однако ржавчина также может нанести вред окружающей среде. Когда ржавчина образуется на поверхности металлов, она часто отслаивается и оставляет за собой следы. Это может привести к загрязнению воды и почвы, особенно в случаях, когда ржавчина образуется на металлических предметах, используемых в промышленности или в бытовых целях. Ржавчина может содержать в себе различные токсические вещества, которые могут попадать в природные источники воды или почву и наносить вред живым организмам.
Кроме того, процесс образования ржавчины может приводить к износу и повреждению металлических конструкций и оборудования. Это требует дополнительных затрат на ремонт или замену, что в свою очередь может привести к дополнительному использованию ресурсов и энергии, а также к негативному влиянию на окружающую среду в процессе изготовления и утилизации нового оборудования.
В целом, Ферум и его свойства оказывают значительное влияние на окружающую среду. Важно стремиться к минимизации негативных последствий, связанных с образованием ржавчины и использованием металлических материалов, а также внедрять методы и технологии, направленные на сохранение окружающей среды и рациональное использование ресурсов.
Химические свойства растворов Ферума

Растворы Ферума (Fe2O3) обладают рядом химических свойств, которые делают их полезными в различных приложениях и процессах.
1. Растворимость: Хлорид Ферума (FeCl3) и сернокислый Ферум (Fe2(SO4)3) - два наиболее распространенных растворимых солей Ферума. Они растворяются в воде, образуя ионные растворы, которые могут использоваться в различных химических реакциях.
2. Кислотность: Растворы Ферума обычно обладают кислотными свойствами. Например, растворы хлорида Ферума имеют низкий pH и могут реагировать с щелочами, образуя соли и воду. Это делает их полезными в процессе нейтрализации или для изменения кислотно-щелочного баланса в различных системах.
3. Окислительные свойства: Ферум может проявлять окислительные свойства в некоторых реакциях. Например, встречаясь с веществами, которые могут окислиться, растворы Ферума могут самостоятельно окислять эти вещества. Это свойство может быть использовано при проведении ряда химических реакций, в том числе в качестве окислителя или катализатора.
4. Осаждение и образование комплексных соединений: Растворы Ферума могут использоваться для осаждения Ферума в виде гидроксида или других соединений. Они также могут образовывать комплексные соединения с различными лигандами, такими как аммиак, ацетат и другими. Эти свойства могут быть использованы для различных целей, включая обнаружение Ферума в растворах или его экстракцию из растворов.
5. Электрохимические свойства: Растворы Ферума могут демонстрировать электрохимические свойства, такие как возможность быть использованными в электролизе или в качестве электролитов. Это свойство обусловлено наличием ионов Ферума в растворе, которые могут действовать как носители электричества.
В целом, химические свойства растворов Ферума делают их важными для множества приложений в различных научных, промышленных и технологических процессах.
Ферум и его использование в промышленности

Одним из основных способов использования ферума является его применение в производстве стали. Ферум добавляется в сплав с другими элементами, такими как углерод, никель и хром, чтобы создать прочный и устойчивый к коррозии материал. Сталь широко используется в строительстве, машиностроении, автомобильной и авиационной промышленности.
Ферум также применяется в производстве различных видов металлов. Например, железо используется для производства чугуна, который затем может быть превращен в сталь или заливочный чугун. Отливки из чугуна широко применяются в производстве деталей, трубопроводов и других изделий, которые требуют прочности и устойчивости к высоким температурам.
Ферум также находит применение в производстве различных видов сплавов. Например, сплавы ферума с никелем, хромом и другими металлами используются для производства отдельных компонентов электрических проводов и кабелей, которые обладают высокой электропроводностью и стойкостью к окружающей среде.
Ферум также используется в производстве магнитов, которые находят свое применение в различных отраслях промышленности, включая электротехнику, электронику и медицину. Магниты на основе ферума обладают мощным магнитным полем и способны удерживать и перемещать металлические предметы.
Также стоит отметить, что ферум используется в процессе изготовления красок и пигментов. Оранжевый пигмент, известный как окись железа или охра, получается из оксида ферума и широко применяется в художественных и промышленных красках.
Таким образом, ферум играет важную роль в промышленности, находя применение в производстве стали, чугуна, сплавов, магнитов и красок. Его уникальные свойства делают его необходимым материалом для широкого спектра отраслей промышленности.



