Ковалентная и ионная связи – это два основных типа химических связей, которые образуются между атомами в химических соединениях. Каждый из этих типов связей имеет свои уникальные характеристики и свойства, которые определяют их поведение и структуру соединений.
В ковалентной связи атомы делят электроны, таким образом образуя общие пары электронов между собой. Это значит, что в ковалентной связи электроны переходят от одного атома к другому и образуют область, где они общие для обоих атомов. Такая связь может образовываться между атомами одного и того же элемента или различных элементов.
С другой стороны, ионная связь образуется, когда атом одного элемента отдает электроны атому другого элемента, что вызывает образование положительно и отрицательно заряженных ионов. Таким образом, в ионной связи нет общих пар электронов, а заряженные ионы притягиваются к друг другу, образуя кристаллическую решетку.
В этой статье мы рассмотрим основные отличия между ковалентной и ионной связью, их структуру, свойства и применение в химических соединениях.
Определение ковалентной и ионной связи

Ионная связь - это вид химической связи, образующейся между атомами с противоположными зарядами. В ионной связи один атом отдает электроны другому атому с целью образования ионов с противоположной зарядностью. Образовавшиеся ионы притягиваются друг к другу электростатическим притяжением и образуют ионную решетку.
Локализация заряда в ковалентной и ионной связях
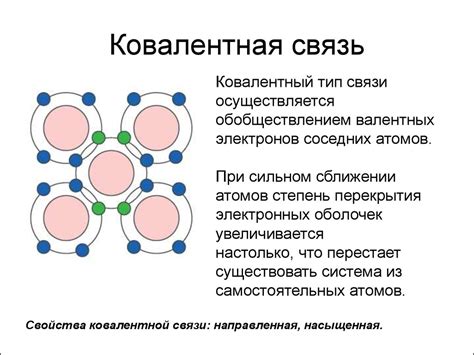
В ковалентной связи электроны между атомами общие, то есть они образуются за счет перекрытия орбиталей атомов. В результате образуется общая электронная пара, которая локализуется между атомами. В ковалентной связи заряд обычно делимый и находится вблизи атомов, создавая электронное облако.
Ионная связь образуется между атомами с разной электроотрицательностью, когда один атом полностью (или частично) передает электроны другому атому. В результате образуются заряженные ионы, которые притягиваются друг к другу электростатическими силами. В ионной связи заряды располагаются вблизи ионов, образуя кристаллическую решетку, в которой заряды ионов уравновешивают друг друга.
Таким образом, разница между ковалентной и ионной связями заключается в том, как заряды электронов распределены между атомами. В ковалентной связи заряд локализуется между атомами, создавая электронное облако, тогда как в ионной связи заряды располагаются вблизи ионов и создают кристаллическую решетку.
Электронное строение молекул при ковалентной и ионной связи
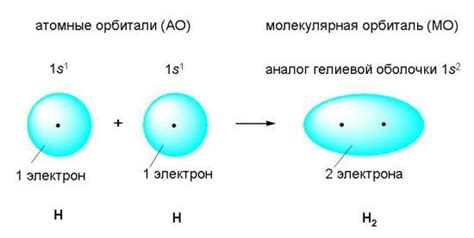
Ковалентная связь формируется при совместном использовании электронов двумя атомами. В результате образуется молекула, в которой электроны образуют пары, распределенные между атомами. Каждый атом вносит в связь по одному электрону, образуя пару связанных электронов. Электроны в ковалентной связи существуют в области пространства, называемой молекулярной орбиталью.
Ионная связь возникает при образовании ионных соединений, когда один атом отдает электрон(ы) другому атому. Это приводит к образованию положительного и отрицательного ионов, которые притягиваются друг к другу электростатической силой. Ионы размещаются таким образом, чтобы обеспечить нейтральность всего соединения.
При образовании ковалентной связи электроны могут находиться в одной области пространства, образуя сильную связь между атомами. Однако при ионной связи электроны находятся в разных областях и занимают разные энергетические уровни. Это приводит к тому, что ионные связи могут быть несколько слабее, чем ковалентные связи.
Таким образом, электронное строение молекул при ковалентной и ионной связи имеет свои уникальные особенности. В ковалентной связи электроны образуют пары и находятся в одной области пространства, образуя сильную связь между атомами. В ионной связи электроны находятся в разных областях и могут занимать разные энергетические уровни, что делает связь несколько слабее. Понимание этих особенностей позволяет лучше понять природу ковалентной и ионной связи и связанных с ними физических и химических свойств.
Свойства веществ с ковалентными и ионными связями

Ковалентная связь характеризуется сильной взаимодействием электронных оболочек атомов, в результате чего образуется молекула. Вещества с ковалентной связью, как правило, обладают низкими температурами плавления и кипения, так как для разрыва ковалентной связи требуется значительное энергетическое воздействие. Это также связано с тем, что молекулы веществ с ковалентной связью обычно образуют сложные трехмерные структуры, которые требуют большого количества энергии для разделения.
Вещества с ионной связью, напротив, образуются в результате электростатического притяжения между положительно и отрицательно заряженными ионами. Ионная связь характеризуется высокими температурами плавления и кипения, так как для ее разрыва требуется большое количество энергии. Вещества с ионной связью обычно образуют кристаллические структуры, в которых ионы располагаются в регулярном порядке.
Вещества с ковалентными связями обычно обладают более низкой проводимостью электрического тока, так как электроны не свободны для перемещения внутри молекулы. Вещества с ионными связями, наоборот, могут проводить электрический ток, так как ионы способны перемещаться в решетке кристалла.
Свойства веществ с ковалентными и ионными связями также определяют их растворимость и химическую реакционность. Вещества с ковалентными связями часто обладают низкой растворимостью в воде и малой химической активностью, так как ковалентные связи требуют значительного энергетического воздействия для разрыва. Вещества с ионными связями, напротив, обычно легко растворяются в воде и проявляют высокую химическую активность, так как ионы могут свободно взаимодействовать с растворителем и другими веществами.
| Свойство | Ковалентная связь | Ионная связь |
|---|---|---|
| Температура плавления и кипения | Низкая | Высокая |
| Проводимость электрического тока | Низкая | Высокая |
| Растворимость в воде | Низкая | Высокая |
| Химическая активность | Малая | Высокая |
Применение ковалентной и ионной связи
Ковалентная и ионная связи находят широкое применение в различных областях науки и техники.
Ковалентная связь используется в химии для создания молекул. Ковалентные связи формируются при совместном использовании электронов внешних оболочек атомов. Это позволяет атомам объединяться в молекулы и образовывать химические соединения различной структуры и свойств.
Ковалентные связи также используются в электронике для создания полупроводниковых материалов. Электронные элементы, такие как транзисторы, используют ковалентные связи для контроля потока электронов и создания логических схем, основанных на принципе электронного переключения.
Ионная связь широко применяется в области материаловедения и электрохимии. Ионные связи образуются при передаче или приобретении электронов между атомами, что приводит к образованию заряженных ионов. Это позволяет создавать материалы с специфическими электромагнитными и химическими свойствами, например, керамику, стекло, соли и многое другое.
Ионные связи также широко используются в электрохимических процессах, таких как электролиз, гальваническая коррозия и батареи. Эти процессы основаны на передаче зарядов через ионную связь и используются для производства различных химических соединений и преобразования энергии.
| Применение ковалентной связи | Применение ионной связи |
|---|---|
| Создание химических соединений | Создание материалов с уникальными свойствами |
| Электроника и полупроводниковые материалы | Электрохимические процессы |



