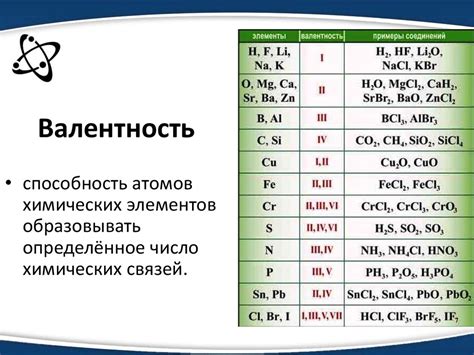
Валентность атома углерода играет ключевую роль в органической химии. Атом углерода является основным элементом в множестве органических соединений, и его способность образовывать связи с другими атомами определяет характер и структуру этих соединений. Валентность атома углерода является показателем его способности образовывать связи с другими атомами, в основном с атомами водорода, кислорода, азота и других элементов.
Атом углерода имеет валентность 4, что значит, что он может образовывать связи с четырьмя другими атмами. Обычно эти связи могут быть одиночными, двойными или тройными. Одиночная связь состоит из одной попарной пары электронов, двойная связь - из двух попарных пар электронов, а тройная связь - из трех попарных пар электронов. Валентность атома углерода также определяет количество других атомов, с которыми он может образовывать связи и образовывать различные органические соединения.
Если атом углерода образует только одиночные связи, то его валентность полностью исчерпывается и он считается насыщенным. Однако если атом углерода образует двойные или тройные связи, то его валентность может быть не полностью исчерпана. В этом случае углеродный атом образует не только связи с другими атомами, но также имеет пространственное строение, которое может быть нелинейным или кольцевым, и приводит к образованию сложных и структурно разнообразных органических соединений.
Валентность атома углерода в органических соединениях

Валентность атома углерода в органических соединениях обычно равна четырем. Это означает, что атом углерода способен образовать четыре связи с другими атомами углерода или другими элементами, такими как водород, кислород, азот и др.
Для образования связи углерода с другими атомами используется его четыре валентные электронные пары. Атом углерода может образовывать одиночные, двойные и тройные связи, в зависимости от количества электронных пар, которые он делит с другими атомами.
Органические соединения, содержащие углерод, обладают огромной химической разнообразностью благодаря способности атома углерода образовывать множество различных связей. Это позволяет создавать сложные структуры и функциональные группы, которые определяют свойства органических соединений.
Важно отметить, что валентность атома углерода в органических соединениях может изменяться в зависимости от типа связи и окружающих атомов. Например, в некоторых случаях атом углерода может образовывать пяти- и шестивалентные соединения, расширяя свои возможности в химических реакциях и образуя более сложные структуры.
Таким образом, валентность атома углерода в органических соединениях играет ключевую роль в определении их свойств и возможностей в химических реакциях. Это понятие лежит в основе множества принципов и теорий, которые используются при изучении органической химии.
Что такое валентность атома
Валентность атома может быть положительной или отрицательной, в зависимости от того, может ли атом отдать или принять электроны. Атомы, которые могут отдать электроны, имеют положительную валентность и называются электронными донорами, а атомы, которые могут принять электроны, имеют отрицательную валентность и называются электронными акцепторами.
Валентность атомов играет важную роль в образовании химических соединений. Атомы могут обмениваться электронами, образуя ковалентные связи, или передавать электроны, образуя ионные связи. Эти связи позволяют атомам объединяться в молекулы и образовывать разнообразные органические соединения.
Валентность атома углерода в органических соединениях зависит от его электронной конфигурации. Углерод имеет 4 электрона в внешней оболочке и может образовать 4 химических связи. Поэтому валентность атома углерода равна 4. Это позволяет углероду образовывать различные структуры и цепочки в органических молекулах, что делает его основным элементом органической химии.
Строение молекул органических соединений
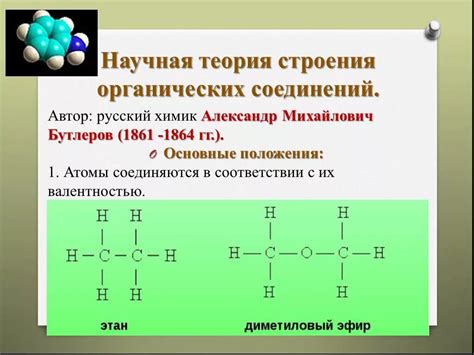
В органических соединениях атомы углерода обычно образуют четыре химические связи. Все эти связи могут быть одинарными или могут содержать двойные или тройные связи. Данный факт определяет валентность атома углерода в органических соединениях. Валентность атома углерода, равная четырем, позволяет ему образовывать сложные структуры и образовывать связи с атомами других элементов.
Строение молекул органических соединений может быть очень разнообразным и зависит от типа связей, атомов, групп функциональности и их взаимного расположения. Молекулы органических соединений могут представлять собой простые одноатомные молекулы или сложные полимерные цепочки. Органические соединения могут также образовывать кольца и содержать различные группы функциональности, такие как карбоксильная кислота, альдегид, кетон, эстер и многие другие.
Органические соединения имеют также специфическую геометрию, которая определяется связями между атомами в молекуле. Это может быть прямое расположение атомов в линейной цепи, или же атомы могут формировать углы, зигзаги или кольца.
Основные типы связей атомов углерода
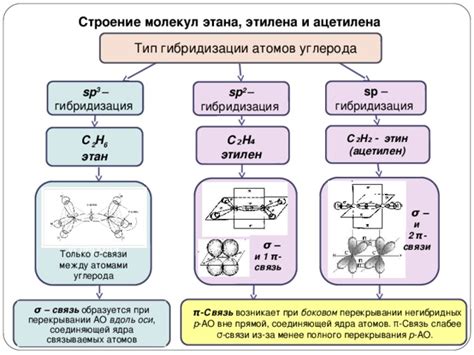
Атомы углерода в органических соединениях имеют возможность образовывать различные типы связей между собой. Эти связи определяют структуру и свойства органических соединений и имеют большое значение в химии углерода.
Одним из основных типов связей атомов углерода является одиночная (насыщенная) связь. Она образуется, когда два атома углерода делают обмен одной общей парой электронов. Такая связь обозначается одной твердой линией и характеризуется наличием одной свободной позиции для образования других связей.
Другим типом связей атомов углерода является двойная связь. Она образуется, когда два атома углерода делают обмен двумя общими парами электронов. Этот тип связи обозначается двумя твердыми линиями и характеризуется наличием одной свободной позиции для образования других связей.
Тройная связь - это еще один тип связей атомов углерода. Она образуется, когда два атома углерода делают обмен тремя общими парами электронов. Тройная связь обозначается тремя твердыми линиями и характеризуется отсутствием свободных позиций для образования других связей.
Кроме того, в органических соединениях могут встречаться двухатомные группы, содержащие атомы углерода, объединенные двойными связями. Эти группы называются двойными связками и имеют особенную реакционную способность.
Таким образом, основными типами связей атомов углерода в органических соединениях являются одиночные, двойные и тройные связи. Эти связи определяют структуру и химические свойства соединений и являются основой для понимания органической химии.
Связь атома углерода с другими элементами

Однако углерод может образовывать и двойные связи, в которых он обменивает две пары электронов с другим атомом. Такие связи образуются, например, в алкенах и кетонах. Двойные связи делают углерод более реакционноспособным и позволяют ему участвовать в различных химических реакциях.
Также углерод способен образовывать тройные связи, в которых он обменяет три пары электронов с другим атомом. Тройные связи образуются, например, в ацетилене. Тройные связи делают углерод особенно реакционноспособным и обеспечивают ему возможность участвовать в сложных химических реакциях.
Связь атома углерода с другими элементами в органических соединениях обусловлена его особенностями строения и электронной конфигурации. Углерод имеет 4 валентных электрона, что позволяет ему образовывать до 4 связей с другими атомами. Это делает углерод основным элементом в химии органических соединений и обуславливает многообразие связей и структур, которые могут образовываться при взаимодействии углерода с другими элементами.
Использование валентности углерода для классификации органических соединений

Валентность атома углерода в органических соединениях играет важную роль в их классификации. Валентность определяет число связей, которые углеродный атом способен образовывать с другими атомами, что в свою очередь влияет на химические свойства и реактивность соединения.
Углерод, как известно, обладает атомным номером 6, что означает наличие 6 электронов в его внешней оболочке. В соответствии с теорией октета, это означает, что углерод может образовывать максимум 4 связи с другими атомами, чтобы достичь стабильной октетной конфигурации.
Валентность углерода может быть использована для классификации органических соединений на основе типов связей, которые он формирует. Например, валентность 4 может быть связана с наличием одной одинарной связи и трех свободных электронных пар, или с двумя двойными связями и одной свободной электронной парой.
Кроме того, валентность углерода в сочетании с типами связей истолковывается для определения функциональных групп в органических молекулах. Например, присутствие двойной связи указывает на функциональную группу алкена, а наличие карбоксильной группы (COOH) указывает на функциональную группу карбоновой кислоты.
Таким образом, использование валентности углерода позволяет систематизировать органические соединения и классифицировать их на основе структурных и функциональных характеристик. Это является важным инструментом в органической химии, позволяющим понять и предсказать свойства и реактивность органических соединений.
Значение валентности атома углерода для определения свойств соединений

Значение валентности атома углерода играет ключевую роль в определении свойств органических соединений. Валентность 4 позволяет углероду образовывать различные типы связей – одинарные, двойные и тройные, что в свою очередь влияет на структуру и поведение соединений.
Способность атома углерода образовывать множество связей делает его основным строительным элементом органических молекул. Благодаря разнообразию углеродных соединений на основе одного атома углерода возможно образование огромного количества различных молекул.
Кроме того, валентность атома углерода позволяет формировать различные структуры, в том числе циклические и ациклические, что влияет на физические и химические свойства соединений. Например, присутствие циклических углеродных структур ведет к образованию ароматических соединений с характерными особенностями строения и свойствами.
Таким образом, значение валентности атома углерода в органических соединениях является важным фактором, определяющим их структуру и свойства. Понимание этого показателя помогает в изучении характеристик органических соединений и их использовании в различных областях науки и промышленности.



