Вода – одно из самых распространенных веществ на Земле. Она играет важную роль во многих биологических и физических процессах, а также в нашей повседневной жизни. Строение молекулы воды имеет несколько особенностей, которые обуславливают ее уникальные свойства.
Молекула воды состоит из трех атомов: двух атомов водорода (Н) и одного атома кислорода (О). Особенностью строения молекулы воды является полюсность. Атом кислорода обладает большим электронным зарядом и притягивает электроны от атомов водорода. В результате этой разности электронных зарядов возникает дипольный момент, который делает молекулу воды полярной.
Полярность молекулы воды приводит к таким уникальным свойствам, как высокая температура плавления и кипения, высокая теплоемкость, хорошая растворимость и поверхностное натяжение. Эти свойства играют важную роль во многих жизненных процессах и явлениях, таких как транспорт веществ в организме, терморегуляция, поглощение и передача тепла, образование микрофаз и т.д.
Химические формулы молекулы воды обычно записываются как H2O. Эта формула показывает, что каждая молекула воды содержит два атома водорода и один атом кислорода. Также иногда используются структурные формулы, которые показывают более подробное расположение атомов в молекуле воды.
Особенности строения молекулы воды

Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О), соединенных ковалентной связью. Каждый атом водорода образует связь с кислородным атомом, образуя угловую формулу молекулы – 104,5 градуса.
Одна из особенностей строения молекулы воды состоит в ее полярности. Поскольку атом кислорода более электроотрицательный, чем атомы водорода, он притягивает электроны к себе и создает частичный отрицательный заряд. В то же время, водородные атомы обладают частичным положительным зарядом. Это приводит к образованию полярных связей между молекулами воды.
Структура воды также определяет ее высокую теплопроводность и теплоемкость. Полярные связи и способность молекулы воды образовывать водородные связи обуславливают большую энергию, необходимую для изменения ее температуры. Поэтому вода обладает высокой теплоемкостью и может накапливать и отдавать тепло, что делает ее важным регулятором климата.
Особенности строения молекулы воды также способствуют ее уникальным свойствам. Воду характеризует высокая коэрцитивность - способность сцепляться со своими молекулами и другими веществами. Это позволяет образовывать поверхностное натяжение, например, водяные капли на листьях растений.
Атомный состав
Молекула воды состоит из трех атомов: двух атомов водорода (H) и одного атома кислорода (O). Атомы водорода связаны с атомом кислорода через ковалентные противолежащие электроны, образуя угловую структуру.
Каждый атом водорода имеет один электрон и одну протонную частицу, в то время как атом кислорода имеет восемь электронов и восемь протонов. Это приводит к тому, что атом кислорода получает от обоих атомов водорода по паре электронов, образуя две ковалентные связи.
Атомный состав, состоящий из двух атомов водорода и одного атома кислорода, является основой для формирования уникальных свойств и характеристик воды, таких как ее молекулярная поларность и способность образовывать водородные связи.
Угловое расположение атомов

Угол между связями между атомом кислорода и атомами водорода составляет около 104,5°. Такое угловое расположение обусловлено электронной структурой молекулы воды.
Водородные атомы обладают положительным зарядом, в то время как кислородный атом имеет отрицательный заряд. Это приводит к образованию полярной ковалентной связи между атомами. Полярность молекулы воды обусловливает ее основные физические и химические свойства.
Важно отметить, что угловое расположение атомов в молекуле воды обеспечивает максимальное устойчивое положение атомов в пространстве, что делает молекулу воды стабильной и способной к образованию водородных связей с другими молекулами.
Свойства молекулы воды

Молекула воды (H2O) обладает множеством уникальных свойств, которые играют важную роль в нашей жизни. Вот некоторые из них:
Полярность: Молекула воды является полярной, что означает, что она имеет неодинаковые электрические заряды в разных частях. Кислородный атом воды негативно заряжен, в то время как водородные атомы положительно заряжены. Это приводит к образованию слабых притяжений, называемых водородными связями, между молекулами воды.
Высокая теплоемкость: Молекула воды способна поглощать и хранить большое количество тепла без значительного изменения своей температуры. Это позволяет воде служить стабилизатором температуры в окружающей среде и в организмах живых существ.
Высокая теплопроводность: Из-за наличия водородных связей молекулы воды тесно связаны друг с другом, что делает их эффективными переносчиками тепла. Вода способна передавать тепло через свою структуру, что является основой многих биологических процессов.
Высокий уровень поверхностного натяжения: Молекулы воды сильно притягиваются друг к другу, формируя поверхностное натяжение. Это свойство позволяет воде образовывать капли и поверхностные слои, которые сопротивляются проникновению других веществ.
Универсальный растворитель: Вода является отличным растворителем для множества веществ, благодаря своей полярности. Большинство поларных и ионных соединений легко растворяются в воде, что позволяет ей выполнять важную роль в биологических и химических процессах.
Значительная плотность при 4°C: Вода имеет наибольшую плотность при температуре 4°C. При дальнейшем охлаждении она расширяется, что имеет важное значение для поддержания жизни в водных экосистемах, например, для замерзания только верхнего слоя воды, который обеспечивает защиту для живых организмов, находящихся в нижних слоях.
Межмолекулярные взаимодействия
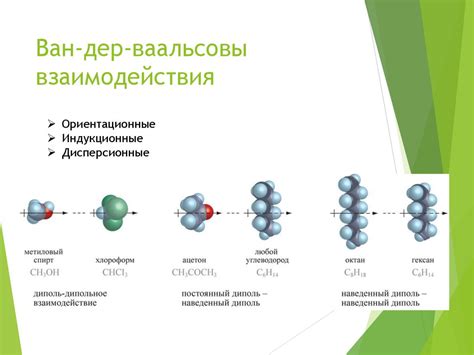
Основными типами межмолекулярных взаимодействий в случае молекулы воды являются водородные связи и дисперсионные силы. Водородные связи - это тип силы притяжения, возникающей между атомом водорода одной молекулы и атомом кислорода соседней молекулы. Это делает молекулу воды очень полярной, а воду - очень хорошим растворителем для других полярных веществ.
Дисперсионные силы, или силы Ван-дер-Ваальса, - это слабые силы притяжения между электронами внутри молекулы и ядрами соседних молекул, обусловленные временными изменениями электронной оболочки. Эти силы притяжения являются причиной того, что молекулы воды могут образовывать жидкость при комнатной температуре и давлении, а также объединяться в кристаллическую решетку при замораживании.
Комбинация водородных связей и дисперсионных сил позволяет воде образовывать уникальную структуру и притягиваться друг к другу. Межмолекулярные взаимодействия в воде также отвечают за ее высокую теплопроводность, поверхностное натяжение и способность к адгезии и когезии. Эти свойства делают воду важным веществом для живых организмов и широко используются в различных процессах и технологиях.
| Свойство воды | Описание |
|---|---|
| Полярность | Обладает положительным полюсом (атом водорода) и отрицательным полюсом (атом кислорода). |
| Высокая плотность в жидком состоянии | Межмолекулярные взаимодействия делают воду плотнее, чем большинство веществ в жидком состоянии. |
| Высокое поверхностное натяжение | Межмолекулярные взаимодействия образуют прочную поверхностную пленку на границе раздела с другими веществами. |
| Высокая теплопроводность | Межмолекулярные взаимодействия быстро передают тепло из одной частицы воды в другую. |
| Уникальное свойство встигания | Межмолекулярные взаимодействия позволяют воде подниматься по узким каналам, образуя столбик. |
Примеры химических формул воды
Молекулярная формула: H2O
Молекулярная формула воды представляет собой сочетание двух атомов водорода (Н) и одного атома кислорода (O). Эта формула позволяет определить состав и количество атомов, входящих в молекулу воды.
Структурная формула:
Структурная формула воды показывает, как атомы водорода и кислорода связаны между собой. Она демонстрирует, что молекула воды имеет угловую форму, где два атома водорода связаны с одним атомом кислорода.
Химическое уравнение: 2H2+ O2 → 2H2O
Химическое уравнение воды показывает, что для образования молекулы воды требуется два молекулы водорода (H2) и одна молекула кислорода (O2). Реакция сопровождается выделением энергии и образованием двух молекул воды.
Ионная формула: H+ + OH- → H2O
Ионная формула воды показывает, что при взаимодействии ионов водорода (H+) и гидроксила (OH-), образуется молекула воды. Водородный катион и гидроксильный анион объединяются, образуя молекулу воды (H2O).
Изотопическая формула: ^1H2^16O
Изотопическая формула воды показывает, что кислород имеет атомный вес 16, а водород – стабильный изотоп 1. Эта формула помогает учитывать изотопные составляющие воды при изучении ее физических и химических свойств.




