Саун 2 - это вещество с уникальными свойствами и характеристиками, которые делают его незаменимым в различных областях науки и техники. Это вещество обладает рядом особенностей, которые делают его одним из наиболее изученных и применяемых веществ.
Основные характеристики Сауна 2 включают его физические и химические свойства, которые определяют его поведение в различных условиях. Саун 2 обладает высокой плотностью и твердостью, что делает его идеальным материалом для производства инструментов и механических деталей.
Кроме того, Саун 2 обладает высокой стойкостью к коррозии и окислению, что делает его незаменимым для использования в химической промышленности и производстве электрооборудования.
Важно отметить, что Саун 2 также обладает высоким сопротивлением к высоким температурам и радиационным воздействиям, что делает его идеальным материалом для использования в ядерной и космической промышленности.
Саун 2 также имеет низкую температуру плавления и кипения, что позволяет использовать его в различных технологических процессах, таких как литье, сплавление и пайка. Более того, Саун 2 обладает высокой теплопроводностью и электропроводностью, что делает его незаменимым для использования в производстве теплопроводных и электропроводящих элементов.
Таким образом, Саун 2 - это уникальное вещество, которое обладает множеством полезных свойств и характеристик. Его разнообразное применение в различных отраслях науки и техники делает его одним из наиболее важных и ценных материалов современности.
Са он 2 - происхождение и структура

Происхождение соединения Са он 2 связано с природными источниками, такими как известняковые и меловые породы. Оттуда его добывают путем обжига при высоких температурах. В результате обжига происходит разложение карбонатного минерала, содержащего кальций, и выделение оксида кальция.
Структура Са он 2 характеризуется кристаллической решеткой, в которой ионы кальция Ca^2+ и ионы кислорода O^2- образуют ионную связь. Соединение обладает кубической решеткой и плотностью в зависимости от исходного материала и условий его получения. Благодаря своей структуре и свойствам, Са он 2 обладает высокой растворимостью в воде и щелочными свойствами.
Использование Са он 2 в различных отраслях промышленности, таких как строительство, химическая и стекольная промышленность, обусловлено его свойствами и доступностью. Также это важное соединение в процессах очистки воды и производства железа, а также используется в производстве удобрений.
Свойства и состав Са он 2

Са он 2, или кальций оксид, представляет собой химическое вещество, состоящее из кальция и кислорода. Его химическая формула CaO. Он обладает рядом уникальных свойств, которые делают его полезным в различных областях.
Одно из основных свойств Са он 2 - его высокая температура плавления. Он плавится при температуре около 2570 °C. Это позволяет использовать его в высокотемпературных процессах, таких как производство стекла и металлургия.
Са он 2 также обладает щелочными свойствами, то есть способностью растворяться в воде и реагировать с кислотами. Это делает его эффективным веществом для нейтрализации кислотных растворов и регулирования pH.
| Физические свойства | Химические свойства |
|---|---|
| Цвет: белый | Химическая формула: CaO |
| Температура плавления: 2570 °C | Растворимость в воде: реагирует |
| Плотность: 3,34 г/см³ | Реакция с кислотами: реагирует |
| Твердость: 5,5 (по шкале Мооса) |
Са он 2 также широко используется в строительной промышленности. Он является одним из основных компонентов цемента и используется для придания прочности и стойкости конструкциям.
В общем, свойства и состав Са он 2 делают его важным и полезным веществом для многих отраслей. Он обладает высокой температурой плавления, щелочными свойствами и широко используется в строительстве и промышленности.
Физические свойства Са он 2

- Плотность: Плотность кальция оксида составляет примерно 3,34 г/см³, что делает его тяжелым и плотным веществом.
- Твёрдость: Са он 2 обладает высокой твёрдостью на Мооса – 9 баллов в десятибалльной шкале.
- Растворимость: Кальций оксид не растворяется в воде, но растворяется в кислотах.
- Теплопроводность: Са он 2 обладает высокой теплопроводностью, превосходящей теплопроводность многих других веществ.
- Температура плавления и кипения: Кальций оксид плавится при очень высокой температуре около 2570°C и не кипит при обычных условиях.
Физические свойства Са он 2 являются важными параметрами для его применения в различных отраслях, таких как строительство, металлургия, стекольная и керамическая промышленность.
Температура плавления и кипения Са он 2
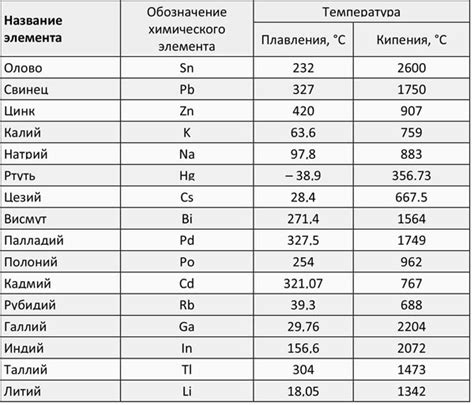
Кальций оксид, также известный как известь или известковый камень, обладает особыми свойствами, связанными с его температурой плавления и кипения.
Температура плавления Са он 2 составляет примерно 2572 градуса Цельсия. Это очень высокая температура, что делает кальций оксид жаропрочным и применимым в различных промышленных процессах, таких как производство стали и цемента.
Однако, кальций оксид не обладает точкой кипения в обычных условиях. Он разлагается при нагревании до температуры около 2850 градусов Цельсия, образуя кальций и кислород. Это явление известно как термическое разложение.
Температура плавления и кипения Са он 2 предопределяют его использование в различных областях науки и промышленности. Знание этих свойств является важным для правильного расчета и выбора методов обработки и применения извести.
Плотность и растворимость Са он 2

Са он 2 является растворимым в воде, что делает его полезным в множестве приложений. Растворимость Са он 2 зависит от температуры: чем выше температура, тем больше вещества можно растворить. При комнатной температуре (около 20°C) растворимость Са он 2 составляет приблизительно 1,28 г/100 мл воды.
Растворимость Са он 2 в воде объясняется его способностью образовывать ионы кальция (Ca2+) и гидроксидные ионы (OH-) при диссоциации. Эти ионы образуют нерастворимые гидроксиды, которые приводят к образованию осадка. Поэтому при добавлении Са он 2 в воду, происходит образование мутности или молочной окраски в растворе.
Кроме воды, Са он 2 может растворяться в других растворителях, например, в кислотах. При этом образуется соль кислоты с кальцием и образуется углекислый газ. Реакция растворения Са он 2 в кислоте происходит с выделением тепла.
Химические свойства Са он 2

Одним из основных химических свойств Са он 2 является его реакция с водой, в результате которой происходит гидратация. Когда Са он 2 контактирует с водой, образуется кальций гидроксид (Ca(OH)2), или известь. Это реакция является экзотермической - освобождается значительное количество тепла.
Кальций оксид также проявляет реактивность при контакте с кислотами. Он образует соль и воду в результате химической реакции. Например, при взаимодействии с соляной кислотой (HCl) образуется хлорид кальция (CaCl2) и вода (H2O).
Еще одним важным свойством Са он 2 является его амфотерность. Это означает, что он может проявлять как кислотные, так и щелочные свойства в зависимости от условий. Например, он может реагировать с кислотами, как уже было упомянуто, но он также может реагировать с щелочами, образуя соль и воду.
Кроме того, Са он 2 обладает высокой температурой плавления и кипения, что делает его важным веществом в процессе производства стекла и цемента. Также он используется в качестве осаждения для удаления сероводорода из газовых потоков и для регулирования уровня pH в различных отраслях промышленности.
| Химическое название | Са он 2 |
|---|---|
| Химическая формула | CaO |
| Молярная масса | 56,077 г/моль |
| Плотность | 3,34 г/см³ |
Реакции Са он 2 с кислотами

В результате реакции Са он 2 может образовывать соли с различными кислотами. Например, реакция Са он 2 с соляной кислотой (HCl) приводит к образованию хлорида кальция (CaCl2) и воды (H2O):
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Также возможна реакция Са он 2 с серной кислотой (H2SO4), в результате которой образуется сернокислый кальций (CaSO4) и вода:
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Реакция Са он 2 с азотной кислотой (HNO3) приводит к образованию нитрата кальция (Ca(NO3)2) и воды:
Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
Таким образом, реакция Са он 2 с кислотами позволяет получать соли кальция и воду. Эти реакции широко используются в химической промышленности и в лабораторных условиях.



