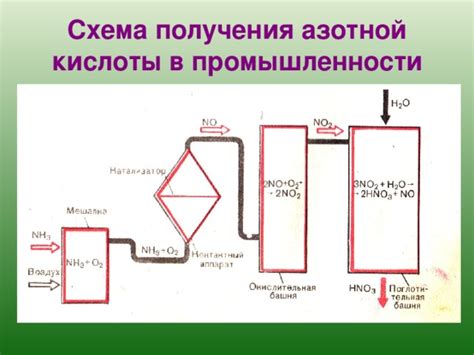
Азотная кислота (HNO3) - это одна из наиболее распространенных и важных химических соединений. Она является сильным окислителем и используется в различных отраслях, включая химическую промышленность, производство взрывчатых веществ и удобрений. При этом, в процессе своего распада азотная кислота образует несколько продуктов, которые обладают своими уникальными свойствами.
Реакция распада азотной кислоты может происходить двумя основными способами: окислительным и восстановительным. В окислительной реакции азотная кислота вступает в реакцию с органическими или неорганическими веществами и передает им свои атомы кислорода. В результате образуются окисленные продукты, а сама азотная кислота изменяется на NO2 (диоксид азота) или NO (окись азота). В восстановительной реакции азотная кислота претерпевает обратный процесс и превращается в другие соединения с более низкой степенью окисления.
Самыми распространенными продуктами распада азотной кислоты являются диоксид азота (NO2), оксид азота (NO), вода (H2O) и кислород (O2). Реакции распада могут происходить как в газообразной, так и в жидкой фазе, в зависимости от условий.
Полное раскрытие темы: реакции распада азотной кислоты

Распад азотной кислоты (HNO3) может привести к различным реакциям и образованию различных продуктов. В зависимости от условий и наличия катализаторов, действие сильной кислоты может протекать по разным механизмам.
Одной из основных реакций распада азотной кислоты является окисление азотной кислоты до азотного оксида (NO). В этой реакции кислород из кислоты переходит на азот, образуя азотный оксид и высвобождая молекулярный кислород. Азотные оксиды, в свою очередь, могут дальше претерпевать реакции.
Другой возможной реакцией распада азотной кислоты является образование кислорода и азотной кислоты с низким содержанием азотной кислоты. В этом случае, часть кислоты разлагается до кислорода, а оставшаяся часть образует кислоту меньшего окисления.
Также, азотная кислота может претерпевать реакцию разложения до нитрогеноксилов (NOx), таких как азотистый оксид (NO) и диоксид азота (NO2). Нитрогеноксилы в свою очередь могут взаимодействовать с воздушным кислородом и другими веществами, образуя новые продукты и участвуя в химических реакциях в атмосфере.
Важно отметить, что реакции распада азотной кислоты могут протекать в разных окружающих средах и под различными условиями. Например, в присутствии катализаторов, температуры, давления и т. д. Также, необходимо учитывать, что реакции могут быть самопроизвольными и могут протекать в контакте с другими веществами или элементами.
В результате реакций распада азотной кислоты образуются различные продукты, которые могут иметь различные свойства. Например, азотные оксиды могут обладать отдушкой и использоваться в производстве капсул для различных применений. Кислород, выделяющийся в результате распада, может поддерживать горение и быть жизненно важным для организмов. А азотная кислота с низким содержанием азотной кислоты может иметь меньшую кислотность и использоваться в различных химических процессах.
Изучение реакций распада азотной кислоты
Когда азотная кислота распадается, одним из возможных продуктов является диазотовая кислота (H2N2O2). Она образуется при обработке азотной кислоты высоким давлением и температурой. Диазотовая кислота обладает ярко выраженными окислительными свойствами и может быть использована в различных химических реакциях.
Другим продуктом реакции распада азотной кислоты является азотистая кислота (HNO2). Эта кислота обладает слабыми окислительными и восстановительными свойствами и может быть использована в качестве реагента в различных химических процессах. Азотистая кислота также является исходным веществом для получения других продуктов.
Изучение реакций распада азотной кислоты позволяет не только получить важные химические соединения, но и развивать методы и технологии их синтеза. Кроме того, изучение этих реакций способствует более глубокому пониманию принципов химии и физики, а также может быть важным для разработки новых материалов и технологий.
Основные продукты распада азотной кислоты

Главными продуктами распада азотной кислоты являются два соединения: оксид азота (II) и оксид азота (IV), более известные как азот(II) оксид и азот(IV) оксид соответственно.
Азот(II) оксид, или известный также как азот протоксид или смехотворный газ, является бесцветным газом с слабым сладковатым запахом. Он обладает свойствами обезболивающего газа и широко применяется в медицине для облегчения боли, а также в пищевой промышленности в качестве добавки E942 для поддержания свежести продуктов.
Азот(IV) оксид, более известный как азотный диоксид, является красно-коричневым газом с едким запахом. Он является сильным окислителем и широко используется в промышленности для получения других соединений азота, а также в качестве антибактериального и антиоксидантного средства.
Важно отметить, что при распаде азотной кислоты могут образовываться и другие продукты, такие как азотистая кислота (HNО3) и водород, но их количество и свойства зависят от условий реакции.
Таким образом, основные продукты распада азотной кислоты - азот(II) оксид и азотный диоксид - обладают уникальными свойствами и нашли широкое применение в различных областях науки и промышленности.
Физические свойства полученных продуктов

Оксид азота (NO2) – красно-коричневый газ с резким запахом, обладает сильным раздражающим действием на слизистые оболочки и органы дыхания.
Вода (H2O), образующаяся в результате реакции распада азотной кислоты, является бесцветной и без запаха. Она не является опасным веществом и хорошо растворяется во многих других веществах.
Азот (N2) – безцветный и бесзапаховый газ, образующийся при распаде азотной кислоты. Азот является основным компонентом воздуха и служит важным питательным веществом для растений и живых организмов.
Оксиды азота (NOx) – это смесь газов, включающая NO, NO2 и N2O4. В зависимости от условий образования и концентрации, оксиды азота могут иметь различные физические свойства, такие как цвет, запах и примеси.
Химические свойства продуктов распада азотной кислоты
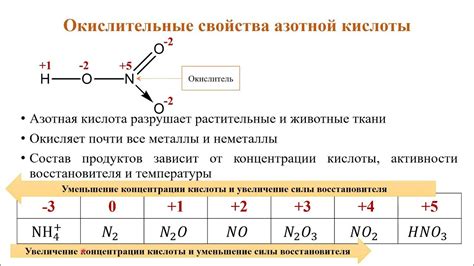
Азотная кислота (HNO3) подвергается распаду в реакции:
HNO3 → NO2 + O2 + H2O
Продуктами этой реакции являются двуокись азота (NO2), кислород (O2) и вода (H2O). Каждый из этих продуктов обладает уникальными химическими свойствами.
Двуокись азота (NO2) представляет собой красно-коричневый газ с характерным резким запахом. Он является сильным окислителем и реагирует с органическими веществами, окисляя их. При взаимодействии с водой NO2 образует азотную кислоту и азотную кислоту оксид. Этот газ также является загрязняющим веществом атмосферы и может приводить к образованию смога.
Кислород (O2) является безцветным газом без запаха. Он является сильным окислителем и необходим для поддержания горения. Кислород также используется в биологических процессах и необходим для дыхания и жизнедеятельности организмов.
Вода (H2O) является безцветной и беспрозрачной жидкостью. Она является универсальным растворителем и играет важную роль во многих химических и биологических процессах. Вода также служит для регулирования температуры организма и смазывания суставов.
Таким образом, продукты распада азотной кислоты - двуокись азота, кислород и вода - обладают различными химическими свойствами и играют важную роль в различных химических и биологических процессах.
Применение продуктов распада азотной кислоты в промышленности

Один из основных продуктов распада азотной кислоты – оксид азота (NO) – находит применение в производстве азотной кислоты и нитратов. Азотная кислота широко используется в производстве удобрений, а также в химической промышленности для синтеза различных соединений, таких как пластмассы, резина, красители и другие органические соединения.
Другой важный продукт распада азотной кислоты – диоксид азота (NO2) – используется в производстве кислорода, красителей, азотной кислоты и нитратов. Кроме того, диоксид азота является важным компонентом атмосферного воздуха и играет важную роль в формировании аэрозолей и глобального климата.
Оксид азота (N2O) – еще один продукт распада азотной кислоты – находит применение в производстве смазок, азотной кислоты, тринитрометана и других химических соединений. Также N2O широко используется в медицине как анестетик, а также в кулинарии в качестве пенообразователя.
| Продукт распада | Применение |
|---|---|
| Оксид азота (NO) | - Производство азотной кислоты и нитратов - Синтез органических соединений |
| Диоксид азота (NO2) | - Производство кислорода, красителей - Роль в атмосфере |
| Оксид азота (N2O) | - Производство смазок и химических соединений - Медицинская и кулинарная применение |
Влияние реакций распада азотной кислоты на окружающую среду

Оксиды азота являются важными загрязнителями атмосферного воздуха. Они способны преобразовываться в атмосфере и образовывать другие вредные вещества, такие как смог, кислотные дожди и озон в нижней атмосфере.
Смог образуется в результате реакции оксидов азота с углеводородными соединениями и присутствием солнечного излучения. Смог обладает вредными свойствами и может вызывать проблемы с дыханием, а также повышать риск сердечно-сосудистых заболеваний.
Кислотные дожди - это результат реакций оксидов азота и сернистого газа с кислородом и влагой в атмосфере. Они могут нанести значительный вред растительности, водным экосистемам и здоровью людей. Кислотные дожди могут вызывать вымирание рыбы и других водных организмов, а также повреждать плодородие почвы и урожайность сельскохозяйственных культур.
Озон в нижней атмосфере, также известный как фотохимический озон, образуется в результате реакции оксидов азота, углеводородных соединений и солнечного излучения. Озон может вызывать раздражение глаз, респираторных путей и вызывать проблемы с дыханием. Он также способен повреждать листья растений и снижать урожайность сельскохозяйственных культур.
Учитывая все эти негативные последствия, важно контролировать реакции распада азотной кислоты в промышленности и взаимодействие с окружающей средой. Необходимо создавать и использовать эффективные методы очистки выбросов из промышленных и автотранспортных источников, чтобы минимизировать воздействие этих реакций на окружающую среду и здоровье людей.



