Электролиз – это химический процесс, основанный на применении электрического тока для преобразования вещества. Этот процесс имеет две разновидности: электролиз раствора и электролиз твердого вещества. Они имеют ряд существенных отличий и применяются в различных областях науки и промышленности.
Электролиз раствора – это процесс электролиза, который проводится в водных или молекулярных растворах. В его основе лежит разложение вещества под действием электрического тока. Вода или раствор вещества разлагается на положительно и отрицательно заряженные ионы, а затем ионы снова соединяются, образуя новые вещества.
В отличие от этого, электролиз твердого вещества проводится на твердой поверхности с использованием электродов. Вещество, подвергнутое электролизу, разлагается под действием электрического тока. В результате происходит изменение его состава или структуры. Этот процесс широко применяется в металлургии и электрохимии для получения металлов и промышленных химических веществ.
Таким образом, основное отличие между электролизом раствора и электролизом твердого вещества заключается в состоянии самого вещества: в растворе или в твердом виде. Каждый из этих процессов имеет свои особенности и области применения, и их освоение является важной задачей современной науки и технологии.
Процесс электролиза

В случае электролиза раствора, электрический ток пропускается через раствор, содержащий ионные соединения. Положительные ионы перемещаются к отрицательному электроду (катоду), а отрицательные ионы - к положительному электроду (аноду). При достижении электродов ионы могут реагировать и образовывать новые вещества, которые могут собираться на электродах в виде отложений или газов.
В случае электролиза расплава, электрический ток пропускается через расплавленное вещество. При этом ионы также перемещаются к электродам и могут реагировать, образуя новые вещества.
Процесс электролиза широко применяется в различных отраслях промышленности, таких как производство металлов, гальваническое покрытие, а также в научных исследованиях и лабораторной практике.
| Преимущества электролиза раствора | Преимущества электролиза расплава |
|---|---|
| Может быть применен для разделения вещества на ионы | Позволяет получать чистые металлы |
| Позволяет проводить химические реакции в растворе | Обеспечивает высокую электропроводность |
Электроды и их состав

Для проведения электролиза растворов и тугоплавких веществ применяются специальные электроды. Они представляют собой проводники, которые позволяют току протекать через раствор и взаимодействовать с веществами на его поверхности.
В электролизе раствора используются два вида электродов:
1. Анод – положительный электрод. В ходе электролиза раствора он сливается и окисляется, а его электроны передаются раствору. Аноды обычно изготавливают из карбона, платины или других материалов, состоящих из непроводящих компонентов с примесью графита или металлического порошка. Такие материалы обладают высокой степенью проводимости и химической стойкостью в агрессивной среде.
2. Катод – отрицательный электрод. Катод в электролизе раствора восстанавливается и принимает электроны из раствора. Катоды изготавливают из таких металлов, как медь, никель, серебро, платина и др. Они обладают высокой электропроводностью и химической инертностью.
Важным параметром электродов является их площадь поверхности. Чем больше площадь электрода, тем больше вещества можно получить или потребовать в процессе электролиза. Поэтому электроды часто имеют форму сетки, решетки или пластины, чтобы увеличить их площадь.
Еще одна важная особенность электродов – степень их очистки от примесей. Поверхность электродов должна быть абсолютно чистой и гладкой, чтобы избежать нежелательных реакций или неравномерного течения тока. Поэтому электроды дополнительно обрабатывают, используя различные методы, такие как полировка или обжиг. Это позволяет повысить эффективность электролиза и улучшить качество получаемых продуктов.
| Материал | Аноды | Катоды |
|---|---|---|
| Карбон | Для электролиза соляной кислоты, серной кислоты | - |
| Платина | Для электролиза воды | - |
| Медь | - | Для электролиза растворов солей меди |
| Никель | - | Для электролиза никелевых растворов |
Температура растворов
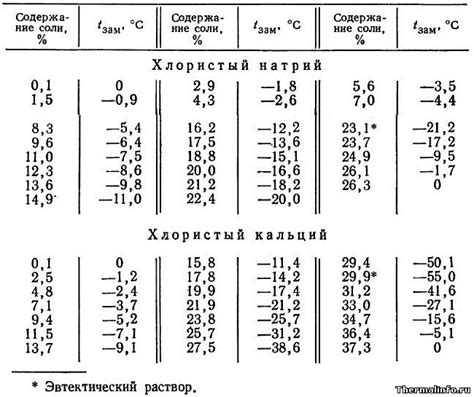
Одно из отличий между электролизом раствора и электролизом плавящихся солей заключается в температуре раствора. При электролизе раствора температура может быть как комнатной, так и повышенной, в зависимости от требований исследования или промышленного процесса.
Когда проводится электролиз раствора при повышенной температуре, возможны некоторые изменения, которые отличаются от электролиза при комнатной температуре. Это может быть связано с изменением растворимости вещества или скоростью протекания реакции.
Например, при повышенной температуре раствор может стать менее вязким, что может способствовать более эффективному перемещению ионов в растворе и повышению скорости реакции. Также повышенная температура может способствовать лучшей проводимости раствора, что также может повлиять на скорость электролиза.
С другой стороны, при электролизе раствора при комнатной температуре, температура остается стабильной и не меняется. Это может быть предпочтительным при исследовании особенностей раствора при определенной температуре или при проведении эксперимента с использованием обычных лабораторных условий.
Таким образом, температура раствора является одним из факторов, который может отличать электролиз раствора и электролиз плавящихся солей.
Используемые электролиты

В случае электролиза раствора, электролитом может быть любое вещество, которое диссоциирует на ионы в растворе. Например, это могут быть кислоты, щелочи или соли. Когда электрический ток проходит через раствор, ионы перемещаются к электродам и происходят различные электрохимические реакции. Таким образом, уникальные свойства раствора электролита влияют на сам процесс электролиза, его эффективность и направление.
В случае электролиза плавления солей, электролитом является сама расплавленная соль. Это может быть любая соль, которая имеет достаточно высокую температуру плавления, чтобы превратиться в жидкую форму. Когда электрический ток проходит через расплавленную соль, происходит электролитическая диссоциация, и ионы перемещаются к электродам, вызывая различные химические реакции. Температура расплавленной соли играет важную роль в электролизе плавления солей, поскольку влияет на скорость реакций и выбранное направление.
Таким образом, выбор электролита является важным фактором при проведении электролиза раствора или электролиза плавления солей, поскольку он оказывает влияние на химические реакции и направление тока.
Скорость процесса

Скорость процесса электролиза раствора и электролиза расплава может существенно отличаться.
В случае электролиза раствора процесс может происходить быстрее из-за увеличенной подвижности ионов в растворе. Это связано с наличием большого количества растворенных ионов, которые могут перемещаться посредством электрического поля. Поэтому скорость электролиза раствора обычно выше.
С другой стороны, при электролизе расплава, скорость процесса значительно медленнее из-за низкой подвижности ионов в расплаве. В расплавленном состоянии частицы вещества находятся в более плотной структуре, что затрудняет их перемещение под воздействием электрического поля. Поэтому процесс электролиза расплава обычно происходит медленнее.
Необходимо отметить, что скорость процесса электролиза может зависеть от конкретных условий, таких как сила тока, концентрация раствора или расплава, температура и другие факторы.
Реакции, происходящие на электродах

Во время электролиза раствора или плавящейся соли происходят различные реакции на электродах, в зависимости от состава раствора и приложенного электрического тока.
На аноде, который является положительным электродом, обычно происходит окисление вещества. Реакция на аноде может быть разной в зависимости от типа электролиза. В случае электролиза раствора может происходить окисление воды, а также окисление анионов, находящихся в растворе.
На катоде, который является отрицательным электродом, происходит противоположная реакция – восстановление вещества. В электролизе раствора восстановление может происходить из-за низкой электропотенциальной силы металла, присутствующего в растворе. Это может привести к образованию отложений металла на катоде.
Таким образом, на аноде происходит окисление, а на катоде – восстановление. Типичные реакции включают окисление воды на аноде и восстановление металла на катоде.
Применение электролиза в промышленности
- Производство металлов: Одним из основных применений электролиза является производство металлов. Например, при использовании электролиза можно получить алюминий, медь, никель и другие металлы. Электролиз позволяет получать металлы высокой чистоты и с заданными свойствами, что делает его важным этапом в металлургической отрасли.
- Производство хлора и щелочи: Электролиз солевых растворов является одним из основных способов получения хлора и щелочи. Процесс основан на распаде солевого раствора на кислород, хлор и гидроксид натрия. Это важный процесс, так как хлор и щелочь используются во многих отраслях промышленности, таких как производство пластмасс, стекла и многих других химических продуктов.
- Электрохимическое осаждение: Электролиз также используется для электрохимического осаждения металлов на поверхности различных материалов. Например, использование электролиза позволяет покрыть металлическим слоем предметы из других материалов, таких как пластик или стекло. Это позволяет улучшить их свойства и дать им дополнительную защиту.
- Гальваническое покрытие: Электролиз также используется для гальванического покрытия, которое широко применяется в промышленности. При гальваническом покрытии на поверхность предмета осаждается тонкий металлический слой. Этот процесс может использоваться для защиты от коррозии, улучшения эстетического вида и декоративных целей.
Применение электролиза в промышленности продолжает развиваться, поскольку это эффективный и экономичный способ получения различных продуктов. Благодаря электролизу мы можем получать металлы, химические вещества и улучшенные материалы, что вносит значительный вклад в различные отрасли промышленности.



