Окислитель-восстановитель - это вещество, которое способно переходить из одного окислительного или восстановительного состояния в другое. Окислительные и восстановительные процессы широко применяются в химии, биологии и других науках.
Окисление - это процесс, при котором вещество теряет электроны и повышает свою окислительную способность. В результате окисления образуются окисленные продукты. Восстановление, наоборот, - это процесс, при котором вещество получает электроны и снижает свою окислительную способность. В результате восстановления образуются восстановленные продукты.
Процессы окисления и восстановления обычно происходят параллельно. Окислитель, участвующий в реакции, получает электроны от вещества, окисляемого, и тем самым сам восстанавливается. В то же время, вещество, окисляемое, отдает электроны окислителю и окисляется.
Примером окислителей могут служить такие вещества, как кислород (O2), хлор (Cl2), перманганат калия (KMnO4). В качестве восстановителей могут выступать вещества, такие как гидроген (H2), натрий (Na), формальдегид (HCHO).
Важно понимать, что окислительно-восстановительные процессы играют важную роль в различных областях науки и техники, и без них не было бы возможно множество химических реакций и преобразований в природе и в лаборатории.
Что такое окислитель восстановитель?

Процессы окисления и восстановления являются важной частью многих химических реакций. В процессе окисления вещество теряет электроны и повышает свой окислительный статус, а в процессе восстановления вещество получает электроны и понижает свой окислительный статус.
Окислитель восстановитель играет роль окислителя в реакции окисления и роль восстановителя в реакции восстановления. Он обычно имеет высокий окислительный статус и может передавать электроны другим веществам. Примерами окислителей восстановителей являются кислород, хлор, пероксиды и некоторые соли металлов.
Окислительно-восстановительные реакции имеют широкое применение в различных отраслях науки и технологии. Они используются, например, в электрохимии, производстве водорода, синтезе органических соединений и очистке воды. Понимание роли окислителей восстановителей позволяет контролировать и оптимизировать эти процессы.
| Окислитель | Восстановитель |
|---|---|
| Кислород | Пероксиды |
| Хлор | Соли металлов |
Что означают понятия "окислитель" и "восстановитель"?
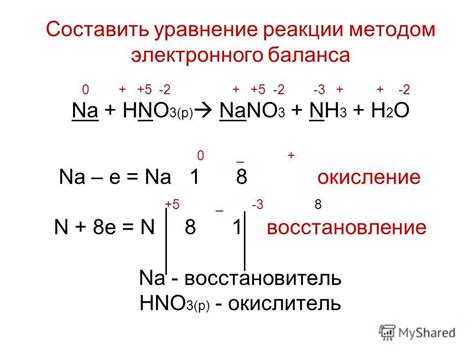
Реакция окисления-восстановления (ОВ реакция) - это химическая реакция, в которой происходит одновременное окисление одного вещества и восстановление другого. Окислитель и восстановитель могут быть в различных физических состояниях - газообразными, жидкостными или твердыми веществами.
Процесс окисления происходит, когда окислитель получает электроны от восстановителя. Окислитель активно взаимодействует с другими веществами, вызывая изменение их свойств и химических составов. Окисление приводит к образованию новых химических соединений и модификации исходных веществ, которые могут быть горючими, коррозионно активными или нестабильными.
Процесс восстановления, напротив, происходит, когда восстановитель передает свои электроны окислителю. В результате происходит изменение свойств окислителя и возможно образование новых соединений. Восстановление может приводить к восстановлению стабильности окислителя и восстановителя, а также вызывать изменение их физических или химических свойств.
Окислительно-восстановительные реакции широко применяются в промышленности, медицине и других областях науки и технологии. Они играют важную роль в процессах производства энергии, обработки материалов, синтеза новых соединений и даже внутри организма человека.
Важно понимать, что окислители и восстановители могут быть опасными веществами, их использование требует соответствующих мер предосторожности и контроля.
Как происходит процесс окисления?

Когда окислитель вступает в реакцию с другим веществом, он отбирает у него электроны, что приводит к образованию положительно заряженных атомов или ионов - катионов. Таким образом, происходит окисление вещества, которое отдает свои электроны в окислитель.
В то же время, происходит процесс восстановления, когда восстановитель передает отобранные электроны обратно окислителю. Это приводит к деокислению вещества, которое восстанавливается, получая электроны от восстановителя.
Процесс окисления-восстановления играет важную роль в химических реакциях и метаболических процессах, таких как дыхание клеток, сжигание топлива, окисление пищи и других биохимических процессах. Кроме того, окисление может приводить к образованию окислов и других соединений, которые могут быть как полезными (например, при образовании пигментов), так и вредными (например, при окислении липидов, что приводит к ранению клеток).
Какие вещества способны подвергаться окислению?

Окисление может происходить со многими веществами, включая металлы, неметаллы, органические и неорганические вещества. Некоторые из наиболее распространенных веществ, подверженных окислению, включают:
- Металлы, такие как железо, медь, алюминий и цинк, которые могут окисляться под воздействием влажности и кислорода, образуя коррозию.
- Ионы железа, которые могут окисляться в присутствии сильных окислителей, таких как хлор и бром.
- Неорганические соединения, такие как сульфиты и сульфаты, которые могут подвергаться окислению в присутствии окислителей.
- Органические соединения, такие как спирты, кетоны и альдегиды, которые могут окисляться в присутствии кислорода или других окислителей.
Окисление является важным процессом в природе и промышленности. Оно играет роль во многих ежедневных процессах, включая горение и окислительное разложение органических соединений.
Какие процессы сопровождают окисление?
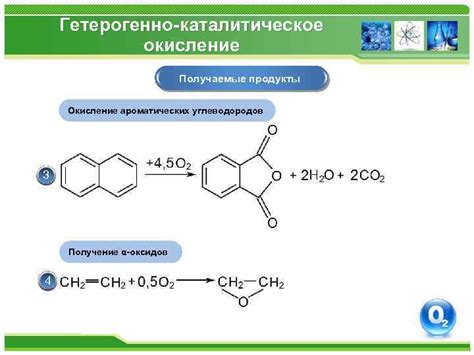
Процесс окисления обычно сопровождается следующими явлениями:
- Образование оксидов. При окислении образуются различные соединения в виде оксидов, например, оксиды металлов или кислорода.
- Изменение окраски. Многие вещества изменяют свою окраску в процессе окисления. Например, железо при окислении становится ржавым.
- Выделение тепла или света. Некоторые окислительные реакции сопровождаются выделением энергии в форме тепла или света. Примером может служить горение или свечение.
- Изменение электропроводности. Вещества в процессе окисления могут изменять свою электропроводность, что может быть использовано для анализа и определения состава смесей.
- Изменение структуры вещества. Окисление может приводить к изменению структуры и свойств вещества. Например, окисление жирных кислот может привести к образованию полимеров и повышению вязкости.
Все эти процессы важны для понимания и применения окислительно-восстановительных реакций в различных областях науки и техники.
Как происходит процесс восстановления?

Процессы восстановления могут происходить на молекулярном уровне в организме, в реакциях взаимодействия различных веществ или в химических реакциях.
Например, в фотосинтезе растений происходит процесс восстановления. Зеленые растения используют солнечную энергию, чтобы превратить углекислый газ и воду в глюкозу и кислород. При этом вода окисляется, отдавая свои электроны, а углекислый газ восстанавливается, получая электроны. Таким образом, растения выпускают кислород в атмосферу и получают энергию для своего роста и развития.
Еще одним примером процесса восстановления является горение. В процессе горения окислитель, как правило, кислород, восстанавливается, принимая электроны от горючего вещества. При этом происходит выделение тепла и образование новых соединений.
Восстановительные процессы широко применяются в промышленности и быту. Например, для восстановления окрашенных волос используются специальные оксигенаторы или пероксиды, которые окисляются и при этом способствуют усилению эффекта окрашивания.
Таким образом, процессы восстановления играют важную роль не только в химии и биологии, но и в различных сферах нашей жизни.
В чем заключается суть процесса восстановления?

Суть процесса восстановления заключается в том, что восстановитель передает электроны окислителю, тем самым позволяя ему восстановиться. Во время реакции происходят изменения окислительного состояния атомов, что сопровождается изменением их зарядов. В результате электронный перенос позволяет превратить окислительное вещество в восстановленное и наоборот.
Процесс восстановления может иметь различные последствия в зависимости от конкретной реакции, так как в некоторых случаях он может сопровождаться образованием новых соединений или выделением энергии в виде тепла или света.
Процессы окисления и восстановления играют важную роль во многих химических и биологических процессах. Они могут быть использованы как в промышленности, например, в производстве металлов или химических веществ, так и в жизненных процессах организмов, таких как дыхание и метаболизм.
Изучение этих процессов позволяет лучше понять механизмы химических реакций и использовать их для различных практических целей, таких как синтез веществ, очистка воды или генерация энергии.
Какие вещества способны подвергаться восстановлению?

Под воздействием окислителя некоторые вещества способны переходить из состояния окисления в состояние восстановления. Такие вещества называются восстановителями. Они обладают свойством отдавать электроны и теряют свою окислительную способность при взаимодействии с окислителями.
К веществам, способным подвергаться восстановлению, относятся некоторые металлы, например, железо, цинк, медь. Они могут реагировать с окислителями, какими-либо веществами или соединениями, и передавать свои электроны, тем самым осуществляя процесс восстановления окислителя.
Также восстановительные свойства проявляют некоторые органические соединения, такие как аскорбиновая кислота (витамин C), глюкоза и другие. Они способны передавать свои электроны при взаимодействии с окислителями и таким образом восстанавливать окислители.
Успешное восстановление окислителя происходит при условии, что вещество, способное к восстановлению, обладает низкими потенциалами окисления и восстановления. Это позволяет протекать реакции восстановления с выделением энергии.
Использование восстановителей имеет большое практическое значение. Они широко применяются в химической промышленности, научных исследованиях, в медицине и других областях.



