Количество электронов на внешнем уровне - одно из важнейших свойств атома, определяющее его химические свойства и способность образовывать химические связи с другими атомами. Элементы таблицы Менделеева расположены в порядке возрастания количества электронов на внешнем уровне, и это свойство играет определяющую роль в их классификации и взаимодействии между собой.
На внешнем уровне атома находятся так называемые валентные электроны, которые определяют его химический характер и способность образовывать химические связи. Чем больше у атома валентных электронов, тем более активным он является химически. Валентные электроны могут участвовать в образовании химической связи с электронами другого атома, образуя молекулы и кристаллические решетки соединений различной структуры и свойств.
Количество электронов на внешнем уровне также определяет химическую реактивность атома. Атомы с неполностью заполненным внешним уровнем стремятся завершить его, чтобы достичь более устойчивой конфигурации. Они могут принимать или отдавать электроны во время химических реакций, образуя ионы и изменяя свою зарядовую структуру. В свою очередь, это определяет способность атома образовывать различные соединения и взаимодействовать с другими веществами.
Количество электронов

Количество электронов на внешнем уровне атома (также называемом валентным уровнем) определяет его химические свойства и способность образовывать химические связи.
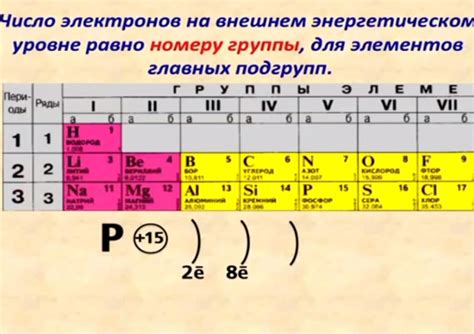
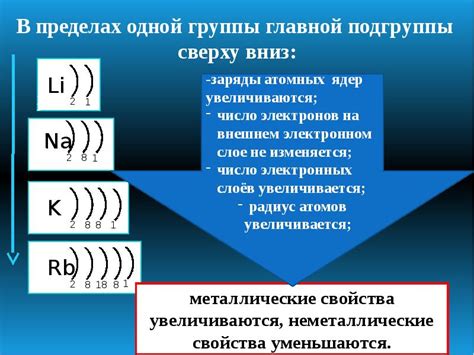
На внешнем уровне атом может содержать от 1 до 8 электронов. Это число определяется его положением в периодической таблице элементов. Например, атомы первого периода (водород и гелий) имеют всего один электрон на внешнем уровне, второго периода (литий, бериллий, бор, углерод и т.д.) - два электрона, и так далее.
Электроны на внешнем уровне имеют особое значение для образования связей между атомами. Атомы, имеющие неполное количество электронов на внешнем уровне, стремятся принять или отдать электроны, чтобы достичь стабильной конфигурации электронов. Это приводит к образованию ионов или обмену электронами в химических реакциях.
Количество электронов на внешнем уровне также определяет тип связей, которые может образовать атом. Атомы с неполным внешним уровнем образуют ионные связи, атомы с полным внешним уровнем (8 электронов) обычно не образуют связей, атомы с неполным внешним уровнем, близким к 8, образуют ковалентные связи.
Например, углерод имеет 4 электрона на своем внешнем уровне и образует 4 ковалентных связи. Натрий имеет 1 электрон на внешнем уровне и образует ионную связь, отдавая этот электрон. Кислород имеет 6 электронов на внешнем уровне и образует 2 ковалентные связи, принимая 2 электрона от других атомов.
Таким образом, количество электронов на внешнем уровне является ключевым фактором, определяющим химические и физические свойства атома и его взаимодействие с другими атомами.
Внешний уровень электронов
Каждый атом стремится достигнуть электронной конфигурации, аналогичной инертным газам, таким как гелий, неон или аргон. Такие атомы имеют полностью заполненный внешний уровень электронов, состоящий из 2 или 8 электронов.
Атомы, у которых внешний уровень не полностью заполнен, обладают химической активностью и стремятся взаимодействовать с другими атомами, чтобы достичь более стабильной электронной конфигурации. В таком случае, количество электронов на внешнем уровне может быть основным показателем реакционной способности атома.
Количество электронов на внешнем уровне можно узнать, изучая расположение атома в периодической системе элементов. Оно может варьироваться от 1 до 8 электронов в зависимости от вида элемента. Например, у атома кислорода на внешнем уровне находятся 6 электронов, а у атома натрия - 1 электрон. Это обуславливает их различные реакционные свойства и способность образовывать связи с другими атомами.
| Элемент | Количество электронов на внешнем уровне |
|---|---|
| Гелий | 2 |
| Неон | 8 |
| Кислород | 6 |
| Натрий | 1 |
Знание количества электронов на внешнем уровне позволяет предсказывать химическую активность элементов и их способность образовывать соединения с другими элементами. Также это имеет важное значение для понимания основ химических связей и реакций между атомами.
Значение количества электронов на внешнем уровне
Количество электронов на внешнем уровне атома играет важную роль в его химических свойствах. Вся химия основана на принципе, что атомы стремятся достигнуть устойчивого состояния, заполнив свои внешние энергетические уровни электронами. Внешний уровень электронов также называется валентным уровнем.
Количество электронов на внешнем уровне определяет химические связи, которые атом может образовать с другими атомами. Если валентный уровень содержит непарные электроны, атом может образовывать ковалентные связи, делая обмен электронами с другими атомами для достижения устойчивости. В противном случае, если валентный уровень полностью заполнен, атом обычно образует ионные связи, путем передачи или получения электронов.
Элементы в периодической системе разделены на группы, основанные на количестве электронов на внешнем уровне. Например, атомы группы 1 имеют один электрон на внешнем уровне, а атомы группы 2 имеют два электрона на внешнем уровне. Это делает их более склонными к образованию ионов с положительным зарядом.
Знание количества электронов на внешнем уровне позволяет определить химические свойства элемента и его реактивность. Это также помогает в понимании, как элементы образуют соединения и как они могут взаимодействовать с другими элементами в химических реакциях.
Распределение электронов по уровням

Электроны, находящиеся в атомах, находятся в различных энергетических уровнях. Они распределены по оболочкам и электронным подуровням. Количество электронов на внешнем уровне, также известное как валентная оболочка, имеет особую роль в химических связях и реакциях.
Периодическая система химических элементов представляет уровни энергии атомов в виде строк, называемых периодами, а оболочки - в виде столбцов, называемых группами. Нулевая группа представляет элементы с полностью заполненными внешними уровнями, поэтому эти элементы обычно неподвижны.
| Номер оболочки | Максимальное количество электронов | Номер группы в периодической системе |
|---|---|---|
| 1 | 2 | 1 |
| 2 | 8 | 2 |
| 3 | 18 | 3-12 |
| 4 | 32 | 13-18 |
| 5 | 32 | 1 |
| 6 | 32 | 2 |
| 7 | 32 | 3 |
Когда электронная оболочка полностью заполнена, атом обычно нейтрален и стабилен. Однако в случае неполного заполнения внешней оболочки, атом стремится завершить ее электронами, участвуя в химических реакциях с другими атомами.
Количество электронов на внешнем уровне также определяет наличие у элемента определенных химических свойств и способность образовывать химические связи. Например, элементы с одним или двумя электронами на внешнем уровне обычно образуют ионные связи, а элементы с пятью, шестью или семью электронами на внешнем уровне обычно образуют ковалентные связи.
Конфигурация электронной оболочки

Конфигурация электронной оболочки определяет количество электронов, расположенных на каждом энергетическом уровне атома или иона.
В замкнутых оболочках, которые представляют собой полностью заполненные энергетические уровни, число электронов равно суммарной вместимости оболочки. Оболочка с максимальной вместимостью чаще всего является внешней, и именно на ней находятся электроны, с которыми взаимодействуют другие атомы.
Количество электронов на внешнем уровне, называемом также валентным уровнем, определяет химические свойства атома. Электроны на внешнем уровне обладают свободной энергией и могут участвовать в химических реакциях, образуя химические связи с электронами других атомов. Валентные электроны можно обозначить символом "x", чтобы указать, что их количество может варьироваться в зависимости от элемента.
Например, у атома кислорода количество валентных электронов равно 6, что позволяет ему образовывать две однонаправленные связи с другими атомами. У атома натрия количество валентных электронов равно 1, что позволяет ему образовывать одну связь.
Конфигурация электронной оболочки определяется следующими правилами:
- Правило Клетцена: каждый энергетический уровень имеет не более 2n^2 электронов, где "n" - номер уровня.
- Принцип заполнения энергетических уровней: электроны заполняют энергетические уровни начиная с нижних.
- Принцип Паули: в каждом энергетическом уровне может находиться не более 2 электронов с противоположными спинами.
- Принцип Гунда: валентные электроны находятся на наиболее высоких энергетических уровнях.
Изучение конфигурации электронной оболочки позволяет понять, как атомы образуют химические связи и какие химические реакции могут происходить между ними.



