Соли и кислоты - это две основные классы химических соединений, которые играют важную роль в нашей повседневной жизни. Однако они имеют существенные различия, и понимание этих различий поможет нам лучше понять их свойства и влияние на окружающую среду.
Первое существенное отличие заключается в их химической структуре: соли образуются в результате реакции между кислотами и основаниями, в то время как кислоты представляют собой соединения, способные отдавать протоны (водородные ионы).
Второе отличие связано с их химическими свойствами: соли обладают щелочными свойствами и могут образовывать растворы, которые при контакте с кожей или слизистыми могут вызывать раздражение. Кислоты, напротив, имеют кислотные свойства и образуют растворы с кислотным pH.
Примерами солей являются такие соединения, как хлорид натрия (NaCl), сульфат магния (MgSO4) и карбонат кальция (CaCO3). Кислотами могут быть такие вещества, как серная кислота (H2SO4), уксусная кислота (CH3COOH) и соляная кислота (HCl).
Соль и кислота: ключевые различия и примеры

Соль:
- Состав: соль состоит из положительно и отрицательно заряженных ионов, которые образуют кристаллическую решетку.
- Источники: соль обычно получают из природных источников, таких как солёные озёра или солевые руды.
- Вкус: соль обладает характерным соленым вкусом.
- Реакция с водой: соль легко растворяется в воде.
- Примеры: натрий хлорид (поваренная соль), серный ангидрид и другие электролиты.
Кислота:
- Состав: кислоты состоят из положительно и отрицательно заряженных ионов, но они не образуют кристаллическую структуру.
- Источники: кислоты могут быть природного происхождения или синтезированы искусственным путем.
- Вкус: кислоты обладают кислым вкусом.
- Реакция с водой: кислоты растворяются в воде, образуя водородные ионы и отрицательные ионы кислотного остатка.
- Примеры: соляная кислота, азотная кислота, уксусная кислота и другие органические и неорганические кислоты.
Таким образом, хотя соль и кислота являются химическими соединениями, отличия между ними заключаются в их составе, источниках, вкусе, реакции с водой и примерах использования.
Что такое соль?

В повседневной жизни мы используем соль в пище для улучшения вкуса и консервации продуктов. Однако соль также имеет много других важных применений, таких как использование в медицинских растворах, производстве стекла и очистке воды.
Существует большое разнообразие солей, каждая из которых имеет свою собственную химическую формулу и свойства. Некоторые из наиболее известных солей включают кухонную соль (хлорид натрия), серную кислоту, алюминиевую соль и карбонат кальция.
- Кухонная соль (хлорид натрия) - самая распространенная соль, которая используется в пище.
- Серная кислота - соль, используемая в производстве удобрений, промышленных растворителей и в других областях промышленности.
- Алюминиевая соль - соль, которая используется в производстве косметических и фармацевтических товаров, а также в качестве противоприпухлевого средства.
- Карбонат кальция - соль, используемая в производстве цемента, стекла и красок, а также в качестве пищевой добавки.
Одно из основных различий между солью и кислотой заключается в том, что соль обычно является нейтральным веществом, тогда как кислота является кислотным. Соли часто образуются путем реакции кислоты с основанием.
Определение кислоты

Когда кислоты растворяются в воде, они проявляют кислотные свойства, такие как изменение pH раствора и реакция с основаниями и металлами. Кислоты обычно имеют кислый вкус, их растворы имеют характерные кислотные запахи и способны разъедать и корродировать материалы.
Неорганические кислоты образуются путем сочетания элемента водорода с элементом более электроотрицательным, чем он сам. Примерами неорганических кислот являются серная кислота (H2SO4), соляная кислота (HCl) и азотная кислота (HNO3).
Органические кислоты образуются при добавлении группы карбоксильной кислоты (-COOH) к органическому соединению. Типичным примером органической кислоты является уксусная кислота (CH3COOH).
Кислоты играют важную роль в ежедневной жизни. Они используются в медицине, пищевой промышленности, сельском хозяйстве, производстве удобрений и многих других областях.
Состав и структура соли
Соль состоит из ионов, образующихся при растворении кислоты в воде. Эти ионы далее организуются в сетку кристаллической структуры.
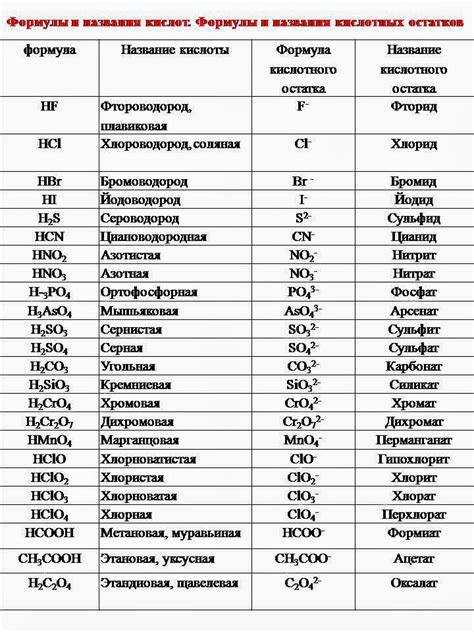
В составе солей присутствуют положительные ионы металлов и отрицательные ионы, которые являются остатками кислот. Такие кислотные остатки называют солепредельными группами. Примеры кислотных остатков в соли:
- Нитратные ионы: NO3-
- Хлоридные ионы: Cl-
- Сульфатные ионы: SO42-
- Фосфатные ионы: PO43-
Кристаллическая структура солей образуется благодаря силам притяжения между положительными и отрицательными ионами. Эти силы обусловливают регулярное расположение и связывание ионов в решетке кристалла.
Структурные особенности и способность образовывать кристаллическую решетку соли зависят от свойств металла и кислотного остатка. Поэтому у различных солей может быть разное строение, а следовательно, и разные свойства.
Химический состав кислот

Кислоты представляют собой класс химических соединений, которые обладают кислотными свойствами. Химический состав кислот включает в себя ион водорода (H+) и отрицательный ион, называемый анионом. В качестве аниона могут выступать различные элементы или группы элементов.
Примеры кислот и их химический состав представлены в таблице:
| Название кислоты | Химический состав |
|---|---|
| Соляная кислота (HCl) | Водородный ион (H+), хлоридный ион (Cl-) |
| Серная кислота (H2SO4) | Два водородных иона (H+), сульфатный ион (SO4^2-) |
| Уксусная кислота (CH3COOH) | Водородный ион (H+), ацетатный ион (CH3COO-) |
Кислоты играют важную роль в химических реакциях и являются необходимыми компонентами во многих процессах в природе и промышленности.
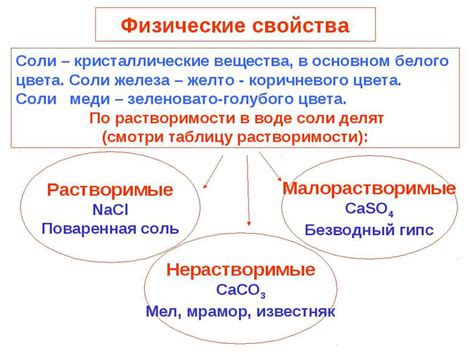
Физические свойства солей и кислот

1. Растворимость: большинство солей хорошо растворимы в воде, но некоторые могут быть нерастворимыми.
2. Точка плавления: соли имеют высокие точки плавления и, как правило, являются твердыми веществами при комнатной температуре. Однако, некоторые соли имеют низкую точку плавления и могут быть жидкими или твердо-жидкими.
3. Кристаллическая структура: соли образуют кристаллические структуры с определенными формами и симметрией.
4. Электролитическое поведение: в растворах соли разделяются на ионы, что позволяет им проводить электрический ток.
Кислоты - это соединения, обладающие кислотными свойствами, то есть способностью давать ионы водорода (H+) в растворе. Физические свойства кислот включают:
1. Кислотность: кислоты обладают кислым вкусом и могут изменять свойства индикаторов кислотности.
2. Растворимость: многие кислоты хорошо растворимы в воде. Однако, некоторые кислоты могут быть нерастворимыми или слабо растворимыми.
3. Вязкость: кислоты могут иметь различную вязкость, в зависимости от их состояния и концентрации.
4. Электролитическое поведение: в растворах кислоты разделяются на ионы и могут проводить электрический ток.
Примеры солей и кислот

Ниже приведены некоторые примеры солей и кислот:
| Соли | Кислоты |
|---|---|
| Хлорид натрия (NaCl) | Хлороводородная кислота (HCl) |
| Сульфат магния (MgSO4) | Серная кислота (H2SO4) |
| Карбонат кальция (CaCO3) | Угольная кислота (H2CO3) |
| Ацетат алюминия (Al(CH3COO)3) | Уксусная кислота (CH3COOH) |
Это лишь некоторые примеры, и на самом деле существует множество других солей и кислот, каждая из которых имеет свои уникальные свойства и применения в различных областях.
Применение солей и кислот в нашей жизни
Применение солей:
- Соли используются в качестве удобрений в сельском хозяйстве для повышения плодородности почвы.
- Соли применяются в процессе приготовления пищи для придания блюдам особого вкуса и аромата.
- Многие соли используются в качестве пищевых добавок для сохранения и улучшения качества продуктов.
- Соли, такие как хлорид натрия (NaCl), применяются в качестве средств для очистки и дезинфекции, например, при приготовлении растворов для полоскания горла.
- Соли используются в косметической промышленности для создания скрабов, масок и других средств по уходу за кожей.
Применение кислот:
- Кислоты используются в химической промышленности для производства различных веществ, например, синтетических полимеров, удобрений, пластиков и многих других.
- Некоторые кислоты применяются в медицине для производства лекарственных препаратов и растворов для инъекций.
- Многие кислоты используются в пищевой промышленности для приготовления различных продуктов, таких как консервированные овощи, соки, соусы и многие другие.
- Кислоты используются в бытовых условиях для растворения накипи, удаления ржавчины и очистки различных поверхностей.
- В атомной энергетике кислоты используются для обработки ядерного топлива и очистки оборудования.
В целом, соли и кислоты являются важными компонентами нашей повседневной жизни. Они находят широкое применение в различных отраслях промышленности, медицине, сельском хозяйстве и бытовых условиях, и без них наша жизнь была бы значительно сложнее.



