Взаимосвязь между pH и кислотностью является одной из фундаментальных концепций в химии и биологии. pH – это мера кислотности или щелочности вещества и определяется концентрацией водородных ионов (H+) в растворе. Чем выше концентрация H+ и pH ниже, тем более кислотным считается раствор, а чем ниже концентрация H+ и pH выше, тем более щелочным считается раствор.
Понимание взаимосвязи между pH и кислотностью имеет важное значение для множества научных и практических областей. В биологии, например, кислотно-щелочной баланс организма играет важную роль для поддержания здоровья и нормальной функции органов и систем.
Помимо биологии, знание о pH особенно важно в химической и пищевой промышленности. Оно позволяет контролировать и регулировать процессы, связанные с приготовлением пищи, производством лекарственных средств и многими другими промышленными процессами.
Основные понятия

Кислотность обусловлена концентрацией водородных ионов (H+) в растворе. Чем выше концентрация H+ и, следовательно, ниже pH, тем более кислотным считается раствор. Самый кислотный раствор имеет pH 0, что означает наивысшую кислотность.
Щелочность определяется концентрацией гидроксидных ионов (OH-) в растворе. Чем выше концентрация OH- и, следовательно, выше pH, тем более щелочным считается раствор. Самый щелочной раствор имеет pH 14, что означает наивысшую щелочность.
Кислотность и щелочность взаимосвязаны и образуют обратную шкалу, поэтому изменение pH на единицу влечет за собой изменение кислотности или щелочности в 10 раз. Например, раствор с pH 4 будет в 10 раз кислее раствора с pH 5 и в 100 раз кислее раствора с pH 6.
Влияние pH на кислотность
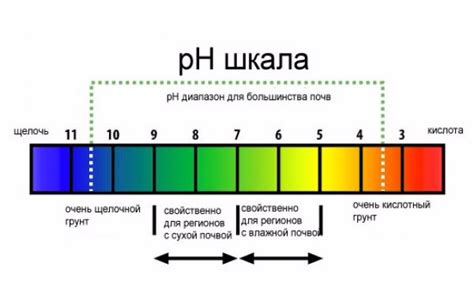
Чем ниже значение pH, тем больше кислотность вещества. Кислотные вещества имеют pH ниже 7, причем чем ниже значение pH, тем более кислотное вещество. Например, батарейный электролит и уксус имеют низкое pH и высокую кислотность.
С другой стороны, чем выше значение pH, тем более щелочным является раствор или вещество. Щелочные вещества имеют pH выше 7, причем чем выше значение pH, тем более щелочное вещество. Например, мыльный раствор и молоко обладают высоким pH и низкой кислотностью.
Влияние pH на кислотность является важным для понимания многих химических и биологических процессов. Например, pH играет роль в пищеварении, росте растений, функционировании ферментов и органической растворимости. Кроме того, контроль pH также важен при проведении лабораторных исследований и в производстве различных продуктов.
| Значение pH | Характеристика |
|---|---|
| 0-6 | Кислотное |
| 7 | Нейтральное |
| 8-14 | Щелочное |
Кислотность и ее свойства

Кислотность может влиять на различные свойства вещества:
- Реактивность: кислотные растворы могут обладать высокой реактивностью и способностью взаимодействовать с другими веществами.
- Вкус: многие кислые вещества обладают характерным кислым вкусом. Например, лимонный сок или уксус.
- Коррозия: сильные кислоты могут вызывать коррозию веществ, таких как металлы.
- Уровень растворимости: кислотные вещества могут быть растворимыми или нерастворимыми в воде в зависимости от их кислотности.
- Естественные процессы: некоторые естественные процессы, такие как погода, разложение органических веществ и даже ферментация, могут быть связаны с изменением кислотности окружающей среды.
Кислотность может быть измерена с помощью pH-метра или с использованием индикаторов, которые меняют цвет в зависимости от кислотности раствора.
Взаимосвязь между pH и кислотностью очень важна, так как она позволяет определить уровень кислотности вещества и его влияние на окружающую среду, процессы и взаимодействия с другими веществами.
Измерение pH

Один из самых распространенных способов измерения pH - использование pH-метра. Это электронное устройство, оборудованное специальным электродом, который позволяет измерять pH значение раствора. Когда электрод погружается в раствор, происходит обмен ионами между электродом и раствором, и это позволяет определить pH значение.
Для измерения pH также можно использовать pH-индикаторы. Это химические вещества, которые меняют цвет в зависимости от pH значения раствора. Например, универсальный индикатор меняет свой цвет от красного (кислотный) до фиолетового (щелочной), причем различные оттенки цвета соответствуют определенным значениям pH.
Измерение pH широко используется в различных областях, таких как пищевая промышленность, фармацевтика, экология и многих других. Точное определение pH позволяет контролировать и регулировать химические процессы, обеспечивать безопасность и качество продуктов, а также изучать воздействие окружающей среды на различные системы.
Практическое применение

Знание взаимосвязи между pH и кислотностью имеет практическое значение в различных областях. Вот несколько примеров:
В пищевой промышленности: Понимание pH помогает в контроле качества пищевых продуктов. Например, для приготовления варенья или маринада pH должен быть достаточно низким, чтобы сохранить продукты. Наоборот, для изготовления йогурта или квашеной капусты pH должен быть достаточно высоким. Знание точного pH продукта помогает поддерживать его стабильность и безопасность для потребления.
В сельском хозяйстве и садоводстве: Уровень pH в почве играет важную роль в росте растений. Кислые почвы могут быть нежелательными для некоторых растений, поскольку могут содержать избыток алюминия или других токсичных веществ. В таких случаях необходимо применять щелочные или нейтрализующие вещества для повышения pH почвы и создания благоприятных условий для роста растений.
В бассейнах и водоочистке: Контроль pH в бассейнах и водоочистных системах является неотъемлемой частью их правильной эксплуатации. Оптимальный уровень pH обеспечивает комфорт и безопасность плавающим людям, а также предотвращает коррозию и повреждение оборудования. Кислотная или щелочная вода также может повлиять на эффективность химического обработки воды и удаления загрязняющих веществ.
В косметической и фармацевтической промышленности: pH является важным параметром во многих косметических и фармацевтических продуктах. Например, многие кремы и лосьоны должны иметь нейтральный или слегка кислый pH для обеспечения безопасности и эффективности использования. Конкретный pH также может влиять на стабильность и долговечность продукта.
Наличие знаний о взаимосвязи между pH и кислотностью позволяет производителям и специалистам в различных областях повышать эффективность своих процессов, обеспечивать безопасность и контролировать качество продуктов.



