Атом - это минимальная частица вещества, имеющая все его химические и физические свойства. Однако, атомы состоят из еще более фундаментальных частиц - протонов, нейтронов и электронов. Каждый атом имеет ядро, в котором находятся протоны и нейтроны, и облако электронов, которое окружает ядро.
Важным понятием в физике атома является элемент. Элемент - это вещество, состоящее из атомов одного и того же типа. Наиболее известные элементы включают в себя водород, кислород, железо и углерод. Каждый элемент характеризуется своим атомным номером, который определяет количество протонов в ядре атома, и своим атомным массовым числом, которое определяет общее количество протонов и нейтронов в ядре.
Важно отметить, что атомы различных элементов могут объединяться, формируя молекулы. Молекулы состоят из двух или более атомов, связанных химическими связями. К примеру, молекула воды состоит из двух атомов водорода и одного атома кислорода. Связи между атомами в молекулах определяют их свойства и возможности в реакциях.
В итоге, понимание основных понятий и характеристик атома является фундаментальным для понимания физических и химических процессов. Познание атомов и их взаимодействий позволяет объяснить многое в мире окружающих нас веществ и объединяет различные области знаний, такие как химия, физика и биология.
Основные понятия

Ядро – центральная часть атома, состоящая из протонов (положительно заряженных частиц) и нейтронов (частиц без заряда).
Электроны – отрицательно заряженные частицы, движущиеся по орбитам вокруг ядра. Они создают электронную оболочку атома.
Энергетические уровни – дискретные значения энергии, на которых могут находиться электроны в атоме.
Электронные орбитали – трехмерные области пространства, в которых с наибольшей вероятностью находятся электроны. Орбитали можно представить как «облака» вокруг ядра.
Протоны – положительно заряженные частицы, находящиеся в ядре атома. Количество протонов определяет химические свойства элемента.
Нейтроны – электрически нейтральные частицы, находящиеся в ядре атома. Они помогают поддерживать стабильность ядра.
Атом в физике: определение и структура
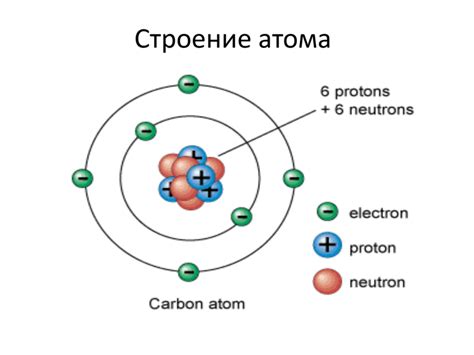
Структура атома состоит из трех основных составляющих: ядра, содержащего протоны и нейтроны, и электронов, вращающихся вокруг ядра на электронных оболочках.
| Частица | Заряд | Масса |
|---|---|---|
| Протон | + | 1 |
| Нейтрон | 0 | 1 |
| Электрон | - | 0 |
Протоны имеют положительный заряд, нейтроны – нет заряда, а электроны обладают отрицательным зарядом. Масса протона и нейтрона приблизительно равна, а масса электрона ничтожно мала по сравнению с ними.
Электроны находятся на разных энергетических уровнях, образуя электронные оболочки вокруг ядра. Количество электронов на каждой оболочке определяется номером атома в периодической таблице элементов. Общее число протонов и электронов в атоме совпадает и определяет его атомный номер.
Характеристики

Первая характеристика атома - его масса, которая измеряется в атомных массах (а.е.).
Вторая характеристика атома - его заряд. Атом может быть заряженным или незаряженным. Заряд атома определяется количеством электронов и протонов в нем. Если число электронов и протонов одинаково, то атом называется нейтральным. Если в атоме присутствует лишний электрон или недостающий, то атом будет иметь отрицательный или положительный заряд соответственно.
Третья характеристика атома - его электронная конфигурация. Электронная конфигурация определяет расположение и количество электронов в атоме. Она определяет химические свойства атома и его способность вступать в химические реакции.
Четвертая характеристика атома - его радиус. Радиус атома определяет его размер. Радиус атома можно измерить в пикометрах (1 пикометр = 10^(-12) метра).
Пятая характеристика атома - его ядерная зарядовая плотность. Ядерная зарядовая плотность атома определяет силу взаимодействия частиц внутри его ядра.
Атом: массовое и зарядовое число

Массовое число атома, обозначаемое символом A, представляет собой сумму протонов и нейтронов в ядре. Оно показывает массу атома в атомных единицах (а.е.м.). Протоны и нейтроны имеют почти одинаковую массу, примерно равную 1 а.е.м. Массовое число можно найти в таблице химических элементов или по формуле A = Z + N, где Z - зарядовое число (число протонов), N - количество нейтронов в ядре.
Зарядовое число атома, обозначаемое символом Z, показывает количество протонов в ядре. Протоны имеют положительный заряд, а электроны, находящиеся в электронной оболочке, имеют отрицательный заряд. В атоме число протонов равно числу электронов, что делает атом электрически нейтральным. Зарядовое число можно найти в таблице химических элементов или равно числу электронов в атоме.
Массовое и зарядовое число атома позволяют идентифицировать химические элементы и определять их свойства.
| Химический элемент | Массовое число (A) | Зарядовое число (Z) |
|---|---|---|
| Водород | 1 | 1 |
| Гелий | 4 | 2 |
| Кислород | 16 | 8 |
Интересные факты

- Атом - это наименьшая единица вещества, которая сохраняет свойства данного вещества.
- Существует около 118 различных химических элементов, из которых состоят все известные вещества.
- Атомы состоят из трех основных частиц: протонов, нейтронов и электронов.
- Протоны имеют положительный электрический заряд, нейтроны - не имеют заряда, а электроны - отрицательный заряд.
- Масса протона примерно равна массе нейтрона и составляет около 1,7 х 10^-27 кг.
- Масса электрона очень мала и составляет около 9,1 х 10^-31 кг.
- Электроны находятся вокруг ядра атома на разных энергетических уровнях.
- Количество электронов в атоме определяет его химические свойства и положение в таблице химических элементов.
- Атомы могут образовывать химические связи друг с другом, образуя молекулы или кристаллическую решетку.
- Исследование атомов и их внутреннего строения помогло создать новые материалы, лекарства, энергетические и технологические решения.
История открытия атома

Древний Греция
В Древней Греции появилась первая идея о существовании неделимых частиц вещества. Древнегреческие философы Демокрит и Лейкт, древнеримский ученый Лукреций предполагали существование атомов – неделимых и непрерывно движущихся частиц.
Эксперименты с газами
В XVII веке произошел прорыв в исследовании атомов. Ученые проводили эксперименты с газами и открыли закономерность сохранения массы при химических реакциях. Это стало первым шагом на пути к открытию атома.
Открытие электрона
В 1897 году Джозеф Джон Томсон опубликовал результаты своих исследований по электрическим разрядам в газах. Он доказал существование электронов – невидимых отрицательно заряженных частиц.
Опыты Резерфорда
В начале XX века Эрнест Резерфорд провел серию известных опытов, в результате которых была открыта структура атома. Он предложил модель "солнечной системы", в которой атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов.
Современное понимание атома
Современное понимание атома базируется на теории квантового механизма, разработанной в XX веке. Она предполагает наличие не только электронов и ядра, но и прочих элементарных частиц, таких как протоны и нейтроны.
История открытия атома – это процесс, который продолжается и развивается. Благодаря работам ученых мы можем лучше понять мир вокруг нас и его основные строительные блоки.
Связанные понятия:

- Электрон. Это элементарная частица, имеющая отрицательный электрический заряд и обитающая вокруг ядра атома.
- Протон. Элементарная частица, имеющая положительный электрический заряд и находящаяся в ядре атома.
- Нейтрон. Частица, не имеющая электрического заряда и также находящаяся в ядре атома.
- Ядро атома. Центральная часть атома, состоящая из протонов и нейтронов.
- Массовое число. Сумма числа протонов и нейтронов в ядре атома.
- Заряд ядра. Равен числу протонов минус число электронов в атоме.
- Электронная оболочка. Область вокруг ядра, где находятся электроны.



