Атом - это основная единица вещества. Он представляет собой наименьшую неделимую частицу, которая обладает свойствами элемента. Все вещества состоят из атомов, которые объединяются в разные комбинации и образуют различные соединения.
Внутри атома находятся податомные частицы: протоны, нейтроны и электроны. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны обладают отрицательным зарядом. Эти частицы размещаются вокруг ядра атома. Протоны и нейтроны находятся в ядре, а электроны движутся по орбитам вокруг него.
Количество протонов в атоме определяет его атомный номер и определяет элемент. Например, атомы с одним протоном в ядре являются атомами водорода, а атомы с 92 протонами в ядре - это атомы урана. Атомы одного элемента могут иметь различное количество нейтронов, что приводит к образованию изотопов.
Атом 7 класс физика: основные понятия

Протоны - это положительно заряженные частицы, которые находятся в ядре атома. Количество протонов определяет химические свойства элемента и называется атомным числом. Нейтроны - это нейтральные частицы, которые также находятся в ядре атома и не имеют заряда.
Электроны - это отрицательно заряженные частицы, которые движутся вокруг ядра атома по электронным оболочкам. Количество электронов также определяет химические свойства элемента. Атомы стремятся иметь полностью заполненные электронные оболочки, чтобы стать стабильными.
Атомы разных элементов имеют различное количество протонов в ядре и, следовательно, разное атомное число. Атомы с одинаковым атомным числом, но с разным количеством нейтронов, называются изотопами. Изотопы одного элемента имеют схожие химические свойства, но различные физические свойства.
Атомы могут образовывать химические соединения путем обмена, присоединения или отрыва электронов. Это объясняет связи между атомами в молекулах и их роль в химических реакциях.
Изучение атомов и их свойств является основой физики и химии, и понимание этих основных понятий помогает нам разобраться во многих аспектах нашего мироздания.
Атом как основной строительный блок материи

Ядро атома состоит из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Они находятся в ядре и отвечают за массу атома.
Вокруг ядра движутся электроны. Они имеют отрицательный заряд и сравнительно малую массу по сравнению с протонами и нейтронами. Электроны находятся на разных энергетических уровнях, которые называются электронными оболочками.
Число протонов в атоме определяет его атомный номер, а число протонов и нейтронов – атомную массу. В периодической системе элементов атомы упорядочены по возрастанию их атомного номера. Отличие одного атома от другого заключается в разном количестве протонов, нейтронов и электронов.
Атомы могут объединяться в молекулы, образуя химические соединения. В результате таких соединений возникают различные вещества с уникальными свойствами. Изучение строения атомов и их взаимодействия позволяет понять множество явлений в природе и разрабатывать новые материалы и технологии.
Строение атома: ядро и электроны
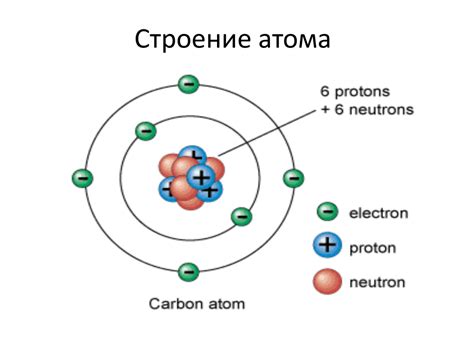
Ядро атома находится в его центре и содержит нейтроны и протоны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Заряд ядра положительный, так как протоны имеют заряд, а нейтроны не влияют на общую электрическую заряд атома.
Электроны находятся вокруг ядра и движутся по определенным орбитам, называемым энергетическими уровнями или электронными оболочками. Они имеют отрицательный заряд и сбалансированы по количеству с положительным зарядом ядра атома.
Строение атома с его ядром и электронами объясняет его свойства и взаимодействие с другими атомами. Взаимодействия атомов между собой в химических реакциях определяются числом и расположением электронов в их внешней электронной оболочке.
Электроны: основные характеристики и расположение
Основные характеристики электронов:
- Масса электрона составляет около 9,1 х 10^-31 килограмма.
- Электроны обладают отрицательным электрическим зарядом, равным элементарному заряду, -1,6 х 10^-19 Кл
- Электроны обладают волновыми свойствами, проявляющимися в их движении через пространство.
- Электроны образуют шелевидные энергетические уровни вокруг ядра, которые определяют их расположение в атоме.
Электроны распределены в атоме по энергетическим уровням и подуровням. Первый энергетический уровень может вместить только 2 электрона, второй - 8 электронов, третий - также 8 электронов.
Наиболее близкие к ядру электроны обладают наибольшей энергией и называются валентными электронами. Они играют важную роль в химических реакциях и образовании химических связей между атомами.
Организация электронов в атоме определяет его химические свойства и возможность взаимодействия с другими атомами. Полное понимание расположения электронов в атоме позволяет объяснить различные явления и свойства вещества.
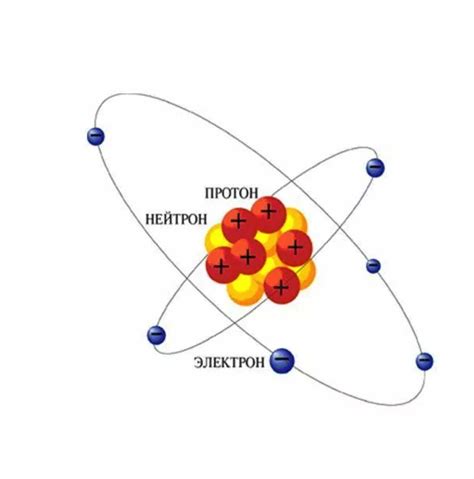
Ядро атома: протоны и нейтроны
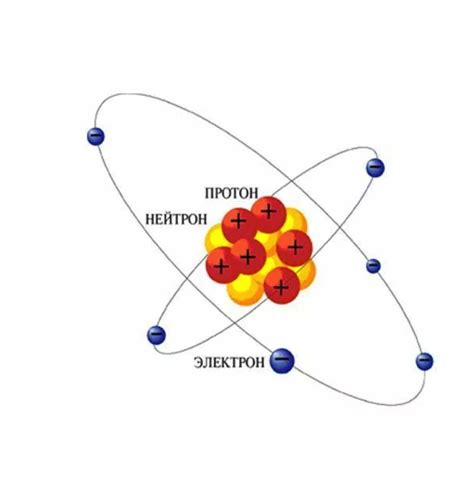
Протоны - это положительно заряженные элементарные частицы, которые находятся в ядре атома. Они имеют массу, равную примерно 1,67262 × 10-27 килограмма и положительный электрический заряд, равный элементарному заряду. Количество протонов в атоме определяет его атомный номер и определяет его химические свойства.
Нейтроны - это нейтральные элементарные частицы, также находящиеся в ядре атома. Они имеют массу, примерно равную массе протона, и нейтральный электрический заряд. Количество нейтронов в атоме может варьироваться, и различные атомы одного и того же элемента, но с разным количеством нейтронов, называют изотопами.
Протоны и нейтроны считаются фундаментальными частицами, а также нуклонами. Они взаимодействуют друг с другом с помощью сильной ядерной силы, которая обеспечивает стабильность ядра атома.
Изучение ядра атома и его составляющих частиц позволяет ученым лучше понять структуру и свойства вещества, а также проводить исследования в области ядерной физики и атомной энергии.
Номер атома. Протоны и электроны

Протоны - это положительно заряженные частицы, которые находятся в ядре атома. Количество протонов в атоме определяет его атомный номер. Протоны имеют массу, поэтому они также влияют на массу атома.
Электроны - это отрицательно заряженные частицы, которые находятся вокруг ядра атома. Они орбитализуют вокруг ядра на разных энергетических уровнях. Количество электронов в атоме также определяет его атомный номер.
Протоны и электроны имеют равные и противоположные заряды, поэтому они притягиваются друг к другу. Сила этого взаимодействия определяет атомные свойства элементов и их способность образовывать соединения.
Изотопы и их свойства
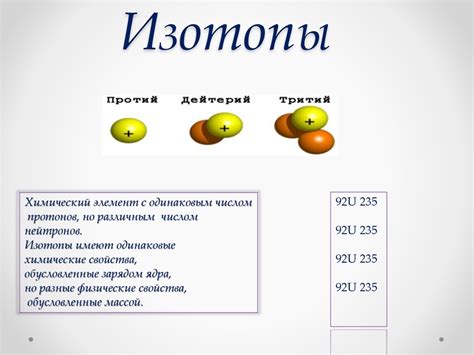
Атомы одного и того же химического элемента, но с различным числом нейтронов в своем ядре, называются изотопами. Такие изотопы имеют одинаковое количество протонов и электронов, поэтому химические свойства у них практически идентичны. Однако отличие в массе атома влияет на его физические свойства.
Изотопы обозначаются с помощью специальной нотации, где в верхнем индексе указывается число нейтронов в ядре атома. Например, для водорода существуют изотопы дейтерий (1 протон и 1 нейтрон) и тритий (1 протон и 2 нейтрона). Обычный водород имеет только 1 протон и никаких нейтронов.
Изотопы могут иметь различные степени стабильности и радиоактивности. Некоторые изотопы могут распадаться со временем и испускать радиацию, в то время как другие изотопы являются стабильными и не подвержены радиоактивному распаду. Радиоактивные изотопы могут использоваться для лечения заболеваний и в научных исследованиях.
Изотопы также могут играть важную роль в археологии и геологии. Например, изотоп углерода-14 используется для определения возраста археологических находок и исследований климата.
Изучение изотопов и их свойств позволяет более глубоко понять строение и свойства атома, а также применять их в различных научных и технических областях.
Энергетические уровни электронов и переходы между ними

Атом состоит из ядра, которое содержит протоны и нейтроны, и электронной оболочки, в которой находятся электроны. Электроны располагаются на определенных энергетических уровнях.
Энергетический уровень - это определенная орбита, на которой может находиться электрон. Чем ближе энергетический уровень к ядру, тем ниже его энергия. Существует несколько энергетических уровней в атоме.
Когда электрон находится на нижнем энергетическом уровне, он находится в основном состоянии. Энергия электрона на нижнем уровне является наименьшей. Если электрон поглощает энергию, он может перейти на более высокий энергетический уровень. Такой переход называется возбуждением электрона.
Когда электрон находится на высшем энергетическом уровне, он находится в возбужденном состоянии. Энергия электрона на высшем уровне является наибольшей. Если электрон в возбужденном состоянии вернется на более низкий энергетический уровень, он испускает избыточную энергию в виде фотона света.
Переход электрона с высшего энергетического уровня на нижний может происходить различными способами. Например, электрон может перейти на нижний уровень путем испускания фотона света (люминесценция) или взаимодействия с другой частицей.
Понимание энергетических уровней и переходов между ними помогает объяснить различные физические явления, такие как испускание и поглощение света, электронные переходы в химических реакциях и освещение атомных спектров.



